【トピックス】
セリン生合成酵素と酵素の動力学パラメータの多様性に関する発見と考察
千葉洋子
理化学研究所・環境資源科学研究センター
1.はじめに
ゲノム科学の目覚ましい発展により、多くの生物の全ゲノムが解読されている。これにより、ゲノム情報からその生物の代謝特性や生理機能、例えば何を炭素・窒素源として生きており、どのような抗生物質に耐性があるのか、といったことが高精度で予測可能となった。これは、注目している遺伝子について実際の実験に基づく情報がなくても、過去に生化学的 (および生理学的) 知見が得られているタンパク質とアミノ酸配列の相同性が一定以上あれば、同じ機能を有するだろうという推定が可能になったことに大きく依存している。ところで、ゲノム情報から存在が推定される酵素を代謝マップ上にプロットした際、一連の反応を触媒する酵素群のうち一部だけが欠けていたとしたら、それは何を意味するのだろうか?その代謝経路は対象生物に存在しないのだろうか?もしもその代謝経路が、対象生物の生存に不可欠と考えられるものだとしたら?本稿では、このような疑問に答えるべく、著者が博士課程の時に着手し、今でも続けているアミノ酸の新規生合成酵素探索プロジェクトについて紹介する。なお、研究成果についてはこれまでにいくつかの邦文1,2)で紹介しているので、ここでは研究の経緯と今後の展開 (特に酵素工学における可能性) に重きを置く。
1-1 セリン生合成経路のmissing linkを発見した背景
2009年4月、私は博士課程の学生として東京大学大学院農学生命科学研究科の応用微生物学研究室に加わった。本研究室では、Hydrogenobacter thermophilusという還元的TCA回路で二酸化炭素を固定し、独立栄養的に生きる好熱性細菌の代謝を長年研究していた。多くの先輩方がこの還元的TCA回路に関わる酵素をH. thermophilusから精製し、それをコードする遺伝子を特定したり生化学的特徴を解析したりして、数々の興味深い知見を報告していた。私もこの微生物の代謝生化学的な解析を通じて代謝進化につながる面白い知見を得たい!と思って本研究室の門を叩いた。
研究テーマを設定するにあたり、私は当時解析が完了したばかりであったH. thermophilusの全ゲノム情報を有効活用したいと考えた。そして、KEGG mapを使ってH. thermophilusの代謝を眺めていたところ、次章に詳述する通りセリン・グリシンの生合成経路にかかわる遺伝子セットが揃っていないことに気付いた。本菌は独立栄養細菌であるから、二酸化炭素からセリン・グリシンを含む全ての細胞構成成分を生合成できるはずである。したがって、本菌は未知なるセリン・グリシンの生合成経路もしくは酵素を有するのだろうと考え、これを見つけることを博士課程での研究テーマとした。
セリンは一般的に、糖代謝の中間産物である3-ホスホグリセリン酸から3つの酵素反応を経るリン酸化経路 (本稿では以降3ステップ経路と呼ぶ) もしくはグリシンに5,10-CH2-テトラヒドロ葉酸のメチレン基を付加する非リン酸化経路で作られる (図1)。前者は不可逆的な代謝経路であると考えられているのに対し、後者は可逆でセリンからグリシンを作ることも可能である。KEGG mapによると、H. thermophilusは3ステップ経路における最初の2ステップの酵素のホモログを有する (そして2番目の反応を触媒する酵素は活性レベルで同定済みである) にもかかわらず、最後の反応 (ホスホセリン→セリン+リン酸) を触媒する酵素phosphoserine phosphatase (PSP)遺伝子を欠く。一方、本菌は非リン酸経路の反応を触媒するserine hydroxymethyltransferase遺伝子を有するものの、基質であるグリシンをセリン以外から生合成する経路が推定できない。すなわち、本菌は未知の代謝経路でグリシンを作り、非リン酸化経路でセリンを作っているか、未知の経路もしくは酵素を用いてセリンを作り、セリンからグリシンを作っていると考えられる。そこでこれらの仮説を酵素活性レベルで検証することにした。
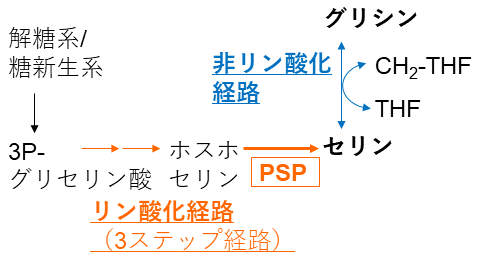

2.新規PSPを用いたリン酸化経路によるセリン合成
2-1 H. thermophilusの有する新規PSP (type2)の発見3)
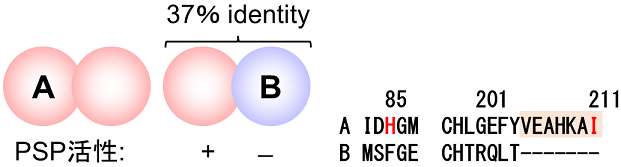
H. thermophilusの菌体破砕液を用いて活性測定を行ったところ、PSP活性が検出された。既知のPSPは3ドメイン (細菌、古細菌、真核生物) どの生物のものも共通の起源を有し (つまり、アミノ酸配列が互いによく似ている) Mg2+依存性を示すのに対し、本菌のPSP活性は2価のカチオン非依存的であった。故に既知のPSPとは全く異なるPSPを有することを確信し、本酵素を精製・同定することにした。カラムクロマトグラフィーを用いてタンパク質を分画し、活性を指標に精製を進めたところ、途中で活性を有する画分が2つに分かれたのでそれぞれ精製した。2つの画分はそれぞれA (HTH_0103) サブユニットのホモ2量体 (AA) とA, B (HTH_0183) サブユニットからなるヘテロ2量体(AB)であった (図2)。興味深いことにA, Bサブユニットは互いに37%のidentityを示し、どちらもcofactor-dependent phosphoglycerate mutase (EC 5.4.2.11; 2-P-D-グリセリン酸<=>3-P-D-グリセリン酸) とアノテートされていた。確かにA, Bサブユニットは本phosphoglycerate mutaseと同じhistidine phosphatase superfamilyに属し、どちらも脱リン酸化反応に関与する活性中心残基を保存している。しかし、基質である2-ならびに3-P-D-グリセリン酸との結合に重要な残基は保存しておらず、phosphoglycerate mutase活性を示さなかったことから、これはミスアノテートであると結論付けた。なお、既知のPSPはhaloacid dehalogenase-like hydrolase (HAD)superfamilyという、数多くの脱リン酸酵素を含む別のスーパーファミリーに属する。よってH. thermophilusの有するPSPは既知のものと進化的起源の異なる新規なPSPであると結論付けた。以降、従来のPSPをtype 1, H. thermophilusから見つかったPSP (下述の通り、正確にはAサブユニット) をtype 2と呼ぶ。

2-2 H. thermophilusの有するtype 2 PSPの性状解析
H. thermophilusの有するPSPのA, Bサブユニットの同異を調べた。両者はどちらもhistidine phosphatase superfamilyにおいて脱リン酸活性に必要な残基を全て保存しているものの、以下に記す通りPSPとしてセリン生合成に直接寄与しているのはAサブユニットだけだった。A, Bサブユニットの各遺伝子破壊株を作製したところ4)、Aサブユニット欠損株はセリン要求性を示したのに対し、Bサブユニット欠損株は独立栄養培地で野生株と同等の増殖を示した。加えて、酵素レベルでもBサブユニットのPSP活性はAサブユニットのそれの1%以下であった5)。Bサブユニットは様々なリン酸化合物に対して微弱な脱リン酸活性を示したものの3)、その生理的な意義は未だ不明である。
A, Bサブユニットのアミノ酸配列比較およびAAタイプの酵素の立体構造解析、そして変異体の動力学パラメータ解析により、AサブユニットのPSP活性に重要な因子を特定した5)。すなわち、85番目のヒスチジン (基質であるホスホセリンのアミノ基と水素結合を形成する) が基質親和性に、活性中心の蓋を形成するC末端の数残基が反応の回転数にそれぞれ寄与していることが明らかとなった。
2-3 Type 2 PSPの生物間分布5)
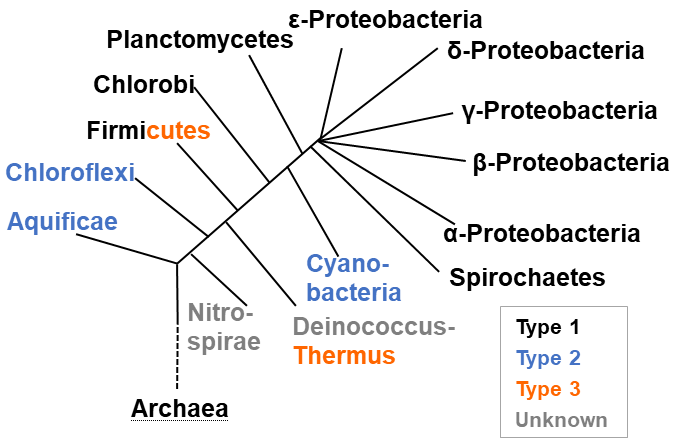
H. thermophilusのPSPを構成するA, Bサブユニットと類似のタンパク質は多様な生物種に存在する。その中からHis85とC末のアミノ酸残基を保存しているもの、すなわちPSP活性を有する可能性が高いものをデータベース上で探索したところ、H.thermophilusを含むAquificae門の生物の大半に加えてCyanobacteria門とChloroflexi門の生物に存在した。これら生物はH. thermophilusと同様に3ステップのセリン生合成経路の最初の2酵素のホモログを有するが、type 1 PSPホモログを有さない。また、Cyanobacteria門とChloroflexi門に属する生物のtype 2 PSPホモログを大腸菌にて発現させたところ、H. thermophilusのそれと同等のPSP活性を示した。すなわち、type 2 PSPの同定およびH. thermophilusのセリン生合成経路の解明は、他の門の生物のセリン合成経路の理解にも貢献した (図3)。
図3 細菌の系統樹とPSPの分布
2-4 Thermus thermophilusの有するtype 3 PSPの同定と性状解析6)
好熱性従属栄養性細菌T. thermophilusはH. thermophilusと同様に3ステップのセリン生合成経路における最初の2酵素のホモログを有するが、古典的なtype 1 PSPホモログを欠く。T. thermophilusはtype 2PSPと似たタンパク質を有するが、そのタンパク質は上述のHis85とC末のアミノ酸残基を保存しておらず、微弱なPSP活性しか示さなかった3)。一方でセリン非添加の合成培地で培養したT. thermophilusの菌体破砕液からは明確なPSP活性が検出されたので、H. thermophilusのときと同様に活性を指標にPSPを精製した。
本菌のPSPはTT_C1695にコードされるタンパク質からなるホモ2量体であった。本遺伝子の破壊株はセリン要求性を示したことから、セリンの生合成に必須であることが示された。TT_C1695は当初、機能不明のHAD superfamilyのタンパク質として同定されていた。HAD superfamilyには様々な基質に対する脱リン酸酵素が含まれており、type 1 PSPもこのスーパーファミリーに属する。しかし、TT_C1695のアミノ酸配列は、type 1PSPよりも非ホスホセリン基質に作用する他の脱リン酸酵素に酷似していたため、blastp検索や系統解析ではTT_C1695をPSPと推定することができなかった。すなわち、同定されたPSPと古典的なtype 1 PSPは、それぞれ独立してホスホセリンに対する基質特異性を獲得したと強く示唆された。そこで、本PSPをtype 3とする。
2-5 Type 3 PSPの生物間分布6)
アミノ酸配列の相同性検索から推定されるtype 3PSPの生物間分布を以下に記す。Deinococcus-Thermus門において、type 3 PSPを有するのはThermus属とMeiothermus属のみであった。また、 (His85が保存されている) type 2 PSPを有する種は見つからなかった。Type 1 PSPホモログはDeinococcus roteolyticusのみから検出された。これはプラスミド上に存在し、αプロテオバクテリアのPSPと65%以上のidentityを示すことから、水平伝播により獲得されたものと考えられる。すなわち、大半のDeinococcales目の生物のセリン生合成経路 (少なくとも一部の生物はセリン生合成能を有することが増殖特性から知られている) は未だ不明である。
Deinococcus-Thermus門以外に目を向けると、T. thermophilusのPSPと35% 程度の identityを示すタンパク質がFirmicutes門の生物の多くに存在する。Firmicutes門の生物の多くは3ステップのセリン生合成経路の酵素のうち最初の2ステップの酵素ホモログを有するが、type 1 PSPホモログを有するのは限られた種のみである。T. thermophilusにおけるtype 3 PSPの発見とほぼ同時期に枯草菌 (Bacillus subtilis) の有するtype 3 PSPホモログが本生物のセリン合成に必須であることが報告された7)。以上をまとめると、type 3 PSPはDeinococcus-Thermus門およびFirmicutes門の一部に分布する (図3)。
3.3タイプのPSPの比較
真核生物および古細菌にはtype 1のみが存在し、真正細菌の系統樹においてはtype 1, 2, 3を有する生物がキメラ状に存在するようである (図3)。これは細菌の進化の過程で、type 1 PSPが消失してtype 2もしくはtype 3PSPが獲得される、というイベントが独立して複数回起きたことを示唆する。このような複雑な進化が起きた理由を推察する一助として、3タイプのPSPの相違を以下で議論する。
Type 1およびtype 3 PSPはHAD superfamilyに属するのに対し、type 2 PSPはhistidine phosphatase superfamilyに属する。Type 1, 3 PSPは2価のカチオン (特にMg2+) 依存的に活性を示す一方で、type 2 PSPの活性には2価のカチオンが不要である。また、基質特異性に関してはtype 1, 3 PSPがL-セリンの前駆体であるL-ホスホセリンに加えてD-ホスホセリンにも同等の活性を有するのに対し、type 2 PSPのD-ホスホセリンに対する活性はL-ホスホセリンに対する活性の1/40以下である。著者が文献を調べた限りD-ホスホセリンの生合成経路は知られておらず、鏡像異性体に対する特異性を示す、もしくは示さないことに対する生理学的なメリットは不明である。まとめると、金属依存性と鏡像異性体選択性に関しては、属するsuperfamilyによって差がある。
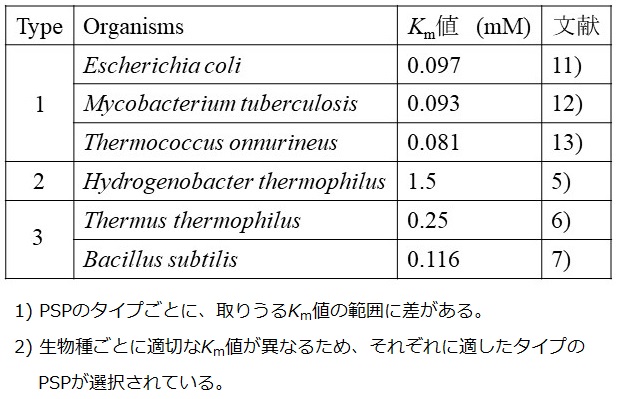
上述以外の相違点として、著者はミカエリス定数、酵素と基質の親和性を表す指標となるKm値に注目している。なぜなら、PSPのタイプによって、L-ホスホセリンに対するKm値の範囲に差がある可能性があるからだ。表1に示すように、既報のtype 1 PSPのKm値はどれも0.1 mM以下であるのに対し、H. thermophilusの有するtype 2 PSPのKm値は1.5 mMであり、10倍以上大きい。そしてどうやらtype 3 PSPのKm値はその中間的な値をとるようだ。サンプル数が少ないし、Km値は温度やpHなどの測定条件によって変化するので断定はできないが、著者は以下の仮説を立てている。
表1 PSPのタイプとKm値の比較
これはまだ仮説の段階であり、現在検証を試みているところである。正直なところ、本仮説を完全に証明することは難しいと考えているが、「生物種ごと (もしくは反応条件ごと) に適切なKm値が存在する」という概念は、酵素進化学および酵素工学に新たな視点をもたらすと著者は考えている。以下、Km値の評価手法について概説する。
4.Sabatier則―最適なKm値の評価手法
これまで酵素の動力学的パラメータは主に以下の2つの視点から評価されてきた。
1) Km値は小さい方が好ましい。なぜならKm値が低ければ、低基質濃度でも酵素は最大活性に近いパフォーマンスを出せるからである。
2) kcat /Kmは触媒効率を表し、この値が大きい方が好ましい。 (本評価にはKmを小さくするとkcat (代謝回転数) が小さくなってしまうというトレードオフが考慮されている。)
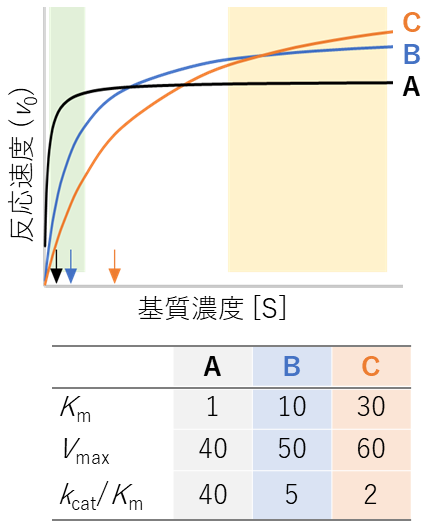
しかし、これらの評価には「どの反応条件において優れているか」という視点が欠けている。図4にKmとVmax (≒kcat) の異なる3種類の酵素の基質濃度依存的な初速度のプロットを示す。Kmが小さく、kcat /Kmが大きいという点ではAが最も優れた酵素である。しかし反応速度が速いものを優れているとするのであれば、高基質濃度ではBやCの方が優れているといえよう。そのため、基質濃度など、ある特定の条件において最適な動力学的パラメータ (特にKm値) を評価する新たな手法が必要であると著者らは考え、触媒化学の経験則であるSabatier則とその拡張理論に注目している。

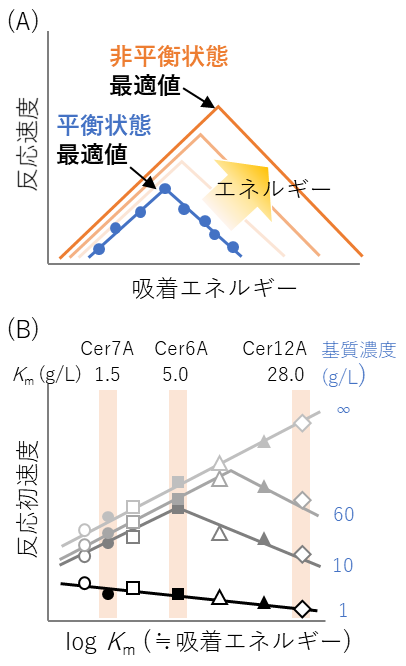
Sabatier則とはノーベル化学賞受賞者のPaul Sabatierが1911年に提唱した触媒化学の法則で (原著はフランス語)、触媒と基質の結合の強さを表す吸着エネルギーは、大きすぎても小さすぎても良くなく、活性を最大化する最適値が存在する、というものである8)。図5Aの青線のように、吸着エネルギーをX軸に、活性をY軸にプロットすると火山型のボルケーノプロットとなり、活性を最大化する吸着エネルギーの最適値が得られる。本法則は実験科学における経験則として提唱され、その後理論的な裏付けもなされている。

2018年、欧州のグループが触媒化学の法則であるこのSabatier則を酵素学に適応した研究を報告した9)。トリコデルマの有する3種類のセルラーゼ (TrCel6A、TrCel7A、TrCel12A) およびTrCel7Aの変異体のKm値 (の比を対数化したもの。これは触媒化学における吸着エネルギーに相当する。) をX軸に、特定の基質濃度での活性 (初速度) をY軸にプロットすると、触媒の場合と同様に火山型になる (図5B)。これは、Sabatier則が酵素に適用できることに具体例をもって言及した初めての論文である。
さらに近年、触媒化学の分野でもSabatier則に関して大きな進展があった。これまでのSabatier則は平衡状態を前提としたものであったのに対し、実際に触媒が使われる非平衡状態、すなわちエネルギーが投入された環境では、活性の大きさだけでなく吸着エネルギーの最適値も変化するという理論予測8)および実験的検証10)が報告されたのだ (図5A, オレンジ)。このSabatier則の拡張理論の視点でセルラーゼの火山型プロットを再度眺めると、一歩踏み込んだ考察が可能になる。触媒化学における投入エネルギー量は、酵素学における基質濃度 (正確には基質濃度と生成物濃度の比であるが、初速度を測定する環境においては基質濃度に近似できる) に相当する。すなわち、図5Bにおいて基質濃度が上がるにつれて山頂が右にずれるのは、基質濃度によって活性を最大化する最適なKm値が異なることを意味する。以上のことから、Sabatier則とその拡張理論の考え方を使えば、それぞれの反応条件に最適なKm値を理論的かつ定量的に評価可能となると期待される。よって今後セルラーゼ以外の多様な酵素にもSabatier則が適応可能かどうかを含め検証することが求められる。
5.おわりに
著者らはセリン生合成酵素PSPに起源の異なる複数タイプが存在することを発見した。そしてPSPが複数回誕生した進化原理について、個々の生物にとって最適なKm値を有する酵素が選択されたという仮説を立てて検証しようとしている。酵素のKm値には条件ごとに最適値があるという概念、そしてそれが具体的にどのような値なのか明らかにする研究手法を確立することは、特定の酵素の進化の理解だけでなく、酵素工学・合成生物学にも幅広く貢献できると期待される。酵素のKm値は細胞内の基質と生成物濃度の比だけでなく、様々な条件に対して最適化されている可能性がある。例えば基質・生成物濃度比の変動に対する応答の仕方 (変動に対して敏感に応答したいのかしたくないのか)、また同じ化合物を基質をとする酵素が細胞内に1種類だけ存在するのか複数存在するのかなどが考えられる。これらKm値の最適化指針が分かれば、ある反応系にどのKm値を有する酵素を導入するのが効果的か予測することが可能になるだろう。もちろん目的のKm値を有する酵素をどのように設計するかという別の課題はあるが、「条件ごとに最適なKm値が存在する」という概念は酵素学に新たな視点を与えてくれるだろう。
謝辞
Sabatier則を用いた酵素化学の研究展開および本稿執筆に際し、理化学研究所中村龍平チームリーダーおよび大岡英史研究員よりたくさんのご助言をいただきました。感謝申し上げます。
文献
1) 千葉洋子: 農芸化学若手女性研究者賞 受賞者講演要旨https://www.jsbba.or.jp/wp-content/uploads/file/45-46.pdf (2020).
2) 千葉洋子: 化学と生物, 59, 458 (2021).
3) Chiba, Y., Oshima, K., Arai, H., Ishii, M., Igarashi, Y.: J. Biol. Chem., 287, 11934 (2012).
4) Kim, K., Chiba, Y., Kobayashi, A., Arai, H., Ishii, M.: J. Bact., 199, e00409 (2017).
5) Chiba, Y., Horita, S., Ohtsuka, J., Arai, H., Nagata, K., Igarashi, Y., Tanokura, M., Ishii, M.: J. Biol. Chem., 288, 11448 (2013).
6) Chiba, Y., Yoshida, A., Shimamura, S., Kameya, M., Tomita, T., Nishiyama, M., Takai, K.: FEBS J., 286, 726 (2019).
7) Price, M. N., Zane, G. M., Kuehl, J. V., Melnyk, R. A., Wall, J. D., Deutschbauer, A. M., Arkin, A. P.: PLoS Genet., 14, e1007147 (2018).
8) Ooka, H., Nakamura, R.: J. Phys. Chem. Lett., 10, 6706 (2019).
9) Kari, J., Olsen, J. P., Jensen, K., Badino, S. F., Krogh, K. B., Borch, K., Westh, P.: ACS Catal., 8, 11966 (2018).
10) Ooka, H., Wintzer, M. E., Nakamura, R.: ACS Catal., 11, 6298 (2021).
11) Kuznetsova, E., Proudfoot, M., Gonzalez, C. F., Brown, G., Omelchenko, M. V., Borozan, I., Carmel, L., Wolf, Y. I., Mori, H., Savchenko, A. V.: J. Biol. Chem., 281, 36149 (2006).
12) Arora, G., Tiwari, P., Mandal, R. S., Gupta, A., Sharma, D., Saha, S., Singh, R.: J. Biol. Chem., 289, 25149 (2014).
13) Jung, T. Y., Kim, Y. S., Oh, B. H., Woo, E. I.: Proteins, 81, 819 (2013).