【トピックス】
大腸菌の外膜小胞高生産株の作製とタンパク質分泌生産等への利用
尾島由紘、東 雅之
阪市大院・工
1.はじめに
グラム陰性細菌が生産する外膜小胞 (OMVs) は、外膜から遊離した直径20~250 nmの細胞外小胞であり、外膜タンパク質やリポ多糖類・リン脂質によって構成される1,2)(図1)。近年になって排出されたOMVsが周囲の細胞に融合することで様々な物質の運搬を行い、遺伝子水平伝搬や細胞間コミュニケーションなど、微生物間相互作用に重要な役割を担っていることが明らかとなり、微生物研究分野で注目を集めている。OMVsの形成機構に関しては、酸化・浸透圧ストレスや熱、抗生物質による損傷で、外膜がたわむことによってOMVsが形成されることが提唱されている1,2)。OMVsの応用研究としては、ワクチン開発やドラッグデリバリーシステムなど分野への寄与が期待されている。

図1 グラム陰性細菌が生産する外膜小胞
一方で、OMVsによって細胞外に分泌される成分の一つに酵素をはじめとしたタンパク質が挙げられ、グラム陰性細菌のタンパク質分泌ツールとしての利用は近年注目を集める応用研究の一つである (図2)。Alvesらは、遺伝子組換えにより有機リン酸化合物パラオキソンの分解を触媒するホスホリン酸トリエステラーゼを大腸菌のOMVs内に内包するように発現させたところ、熱、乾燥、凍結融解などの種々のストレスから酵素が保護され、遊離の酵素と比較して高い活性を保つことができることを実証している3)。
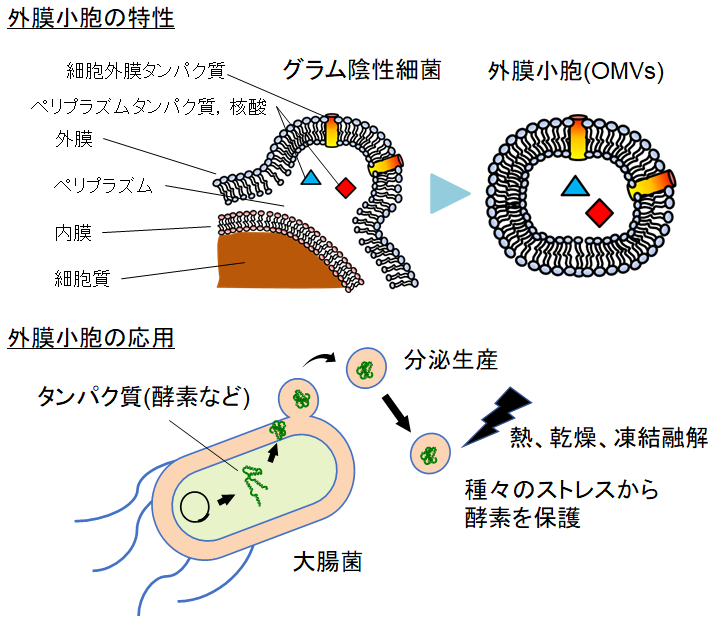
図2 外膜小胞の特性とタンパク質分泌ツールとしての応用
筆者らも、特に大腸菌に着目し、外膜小胞の生産機構も含めた基本的性質を明らかにすると同時に、タンパク質分泌生産ツールとしての有用性を検討してきた4,5)。大腸菌は、タンパク質生産宿主として長く工業的に用いられてきたが、生産したタンパク質を細胞外に分泌できず細胞内に蓄積するため、物理的に生産量が制限される。さらに細胞からの分離・精製過程が煩雑化し、製造コストを高めてしまう問題がある。以上の背景から、本研究では大腸菌の遺伝子改変によりOMVs高生産株を作製し、タンパク質分泌への応用や高生産株細胞の電子顕微鏡観察等を行ったため、以下にその概要を記述する。
2.大腸菌の外膜小胞高生産株の作製と特性解析
2-1 大腸菌のOMVs生産に関わる遺伝子
大腸菌をはじめとしたグラム陰性細菌のOMVsに関しては、物理的な膜ストレスによる損傷で外膜がたわむことによる促進の他、遺伝子の欠損によっても同様の膜ストレスが生じ生産が促進することが報告されていた。図3にこれまで欠損により大腸菌のOMVs生産が促進するとの報告がある代表的なタンパク質を示す。NlpIは、外膜と内膜の間を結ぶペプチドグリカン (PG) の架橋を加水分解する酵素であるMepsの機能を抑制するリポタンパク質である。nlpI遺伝子を欠損することで、MepsによるPGの分解が促進され、PGと外膜の結合が緩む。この結果、外膜が隆起しやすくなり、OMVsの生産が促進されると考えられている6)。一方、DegPはペリプラズム内の不活性なタンパク質を分解するプロテアーゼである。欠損によりペリプラズム内に不活性タンパク質が蓄積することが物理的な膜ストレスを誘導し、不活性タンパク質を細胞外に排出するためにOMVs生産量が増えるとされる7)。
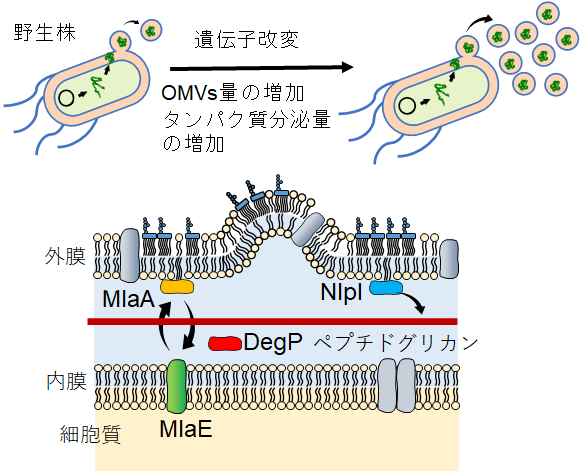
図3 大腸菌の遺伝子改変による外膜小胞の生産促進と、
欠損により生産促進の報告がある膜関連タンパク質
これらの機構とは異なるMlaEは、Yrb-ATP結合カセット (ABCトランスポーター) の膜輸送体で、YrbEとも称される。外膜のリン脂質の輸送に関わっており、内膜へのリン脂質の逆輸送により外膜と内膜のリン脂質の比を一定に保つ役割を果たしている。mlaE遺伝子の欠損により、外膜の外葉からリン脂質が戻ることが出来なくなり、外膜の外葉に脂質が蓄積する。その結果、外膜上で余剰となった脂質が放出されやすくなり、OMVs生産が促進するとされている8)。MlaAはVacJとも称され、MlaEと同じYrb-ATP結合カセットのリポタンパク質として、外膜の外葉と内葉のリン脂質の比を一定に保つために働く。mlaA遺伝子を欠損することで、外膜の外葉と内葉の脂質バランスが崩れる8)。mlaAおよびmlaEの遺伝子欠損によるOMVsの生産促進の効果は、当初グラム陰性菌であるHaemophilus influenzae (インフルエンザ菌) およびVibrio cholerae (コレラ菌) で報告された8)。その後大腸菌においても網羅的な遺伝子欠損株の解析によりmlaAおよびmlaEの欠損によりOMVsの生産が促進することが確認され9)、比較的最近報告されたOMVsの生産促進機構である。
2-2 遺伝子欠損の重ね合わせによる大腸菌のOMVs高生産株の構築とタンパク質分泌生産への利用
本研究では、機能 (遺伝子) 欠損によりOMVs生産を促進させるこれら4つの遺伝子について、P1ファージを用いた形質導入法により、機能 (遺伝子) 欠損を重ね合わせた多重遺伝子欠損株を作製し、生産量を最も増加させる欠損の組み合わせを探索した5)。これらの欠損株をLB培地で24時間培養し、培養液から遠心分離により菌体を除去後、塩析と超遠心分離により、OMVsを濃縮し回収した。OMVs生産量は、回収したOMVs画分をSDS-PAGEで分離した後、37 kDa付近に現れる3種類の外膜タンパク質OmpC、F、Aのバンドの濃淡を数値化し、野生株 (WT) に対する相対量として算出した。結果を図4aに示す。単独欠損株では、ΔnlpI株が最もOMVs生産量が高く野生株の約7倍の値を示した。ΔmlaE、ΔdegP株は約5倍程度、ΔmlaA株は最も低く約3倍の生産量であり、おおよそ過去の報告と一致した。2重遺伝子欠損株については、増加幅のばらつきが大きく、最も低いΔmlaEΔmlaA株では野生株と比較し約5倍で、遺伝子欠損を重ね合わせることによる増加は確認されなかった。両遺伝子とも脂質バランスに関わる遺伝子であることから、相加・相乗効果は生じなかったものと考えられた。一方、それ以外の組み合わせでは、すべて単独欠損株よりもOMVs生産量が増加した。ΔmlaEΔnlpI株が最も高く約30倍に増加した。その他の4株に関しても約20倍程度の値を示したことから、PGの架橋を脆弱化する効果、ペリプラズムの不活性タンパク質が蓄積する効果、外膜外葉の脂質バランスを崩す効果は、それぞれ重ね合わせることで相乗的にOMVs生産を促進することがわかった。ただし、3つの遺伝子欠損を重ね合わせた3重遺伝子欠損株ΔmlaEΔnlpIΔdegP株では、かえってOMVs生産量は減少し、2重遺伝子欠損株ΔmlaEΔnlpIが今回検討した中で、OMVsを最も高生産する株であると結論づけられた。
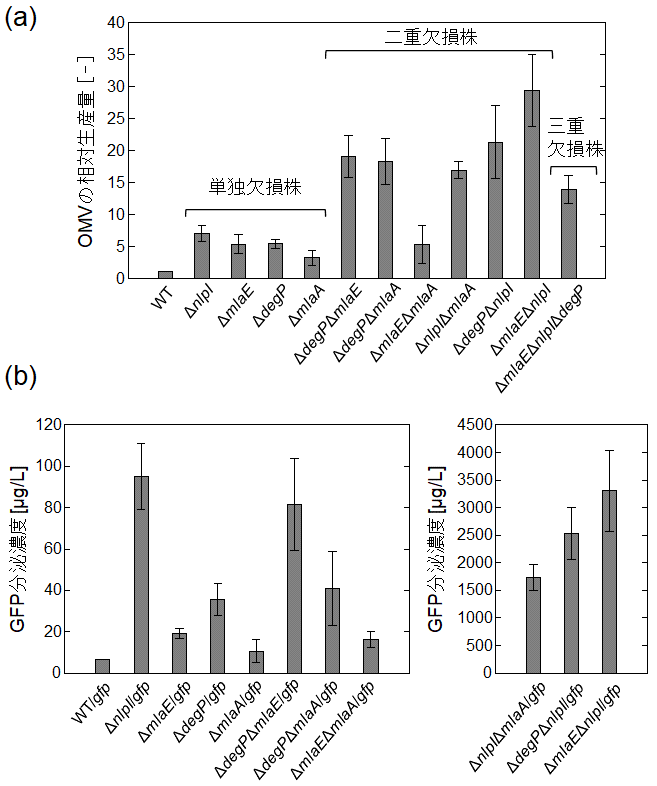
図4 大腸菌の各遺伝子欠損株の外膜小胞の生産量
(a) とGFP分泌濃度 (b)。(文献5)からの改変転載)
続いて、作製した欠損株を用いて、OMVsを介した緑色蛍光タンパク質 (GFP) の培養液中への分泌を検討した。この時、GFPは、OMVs表面に高効率に提示されることが報告されている外膜タンパク質OmpW4)のC末端側に融合させることで、ペリプラズム内に発現させ、OMVs内に内包されるように設計した。回収したOMVs画分をウエスタンブロッティングにより解析し、バンド強度から培地1 Lあたりの分泌量を算出した (図4b)。野生株では、GFP濃度は7µg/Lと非常に低濃度でありほとんど分泌しないことが確認された。単独欠損株の中では、ΔnlpI株が約100µg/Lと最も高い値を示した。一方で、2重遺伝子欠損株に関しては、nlpI遺伝子の欠損が含まれていない3株に関しては、最大でもΔdegPΔmlaE株の約80µg/Lであり、大きな増加は確認されなかった。逆に、nlpIの欠損を含む3つの2重遺伝子欠損株に関しては、総じて桁違いに高いGFP分泌濃度を示し、最も高いΔmlaEΔnlpI株では約3.3 mg/Lと、過去の異なる原理を利用した大腸菌のタンパク質分泌濃度の報告と同等の値となった10)。
2-3 急速凍結レプリカ電子顕微鏡法による外膜小胞高生産株ΔmlaEΔnlpIの細胞観察
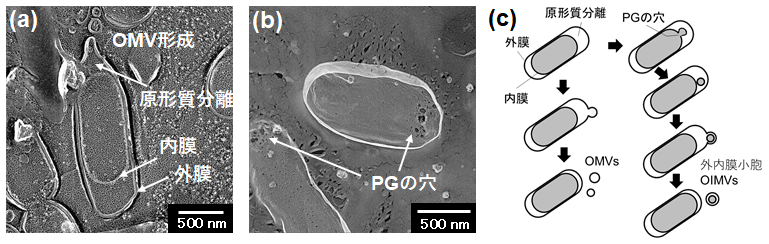
ΔmlaEΔnlpIのOMVs生産量は今回作製した株の中で最も高く野生株の30倍程度であったが、GFP分泌濃度は、400倍以上増加しており、OMVsの増加による効果だけでは説明できない分泌濃度となっていた。ΔmlaEΔnlpI株は野生株と比較して、GFPの細胞内発現量自体が増加している可能性が考えられたため、細胞内のGFP発現量も比較したが、野生株とほぼ同等の発現量であった。そこでさらに原因を探るため、急速凍結レプリカ電子顕微鏡法によって、ΔmlaEΔnlpIの観察を行った。本手法は、活性状態にある生体試料を、液体ヘリウムなどで冷やした金属ブロックに押しつけて凍結し、凍結した試料を割断や蒸発を用いて部分的に露出させ、表面に金属を蒸着してその金属を観察する手法であり、ナノメートルオーダーの解像度で、生体試料を可視化することができる。得られた観察画像を図5aに示す。驚くことに、ΔmlaEΔnlpIでは、細胞の長軸の先端部にペリプラズム空間が広がることで原形質分離が起きている様子や、その先端部から外膜がくびれてOMVsが放出されている様子が観察された11)。この原形質分離は、各単独欠損株でも観察され、OMVs高生産株に特有の形質であると考えられた。さらに興味深い結果として、ΔmlaEΔnlpI細胞のPGを界面活性剤等を用いて抽出し、同様に急速凍結レプリカ電子顕微鏡法によって観察したところ、野生株には見られない大きな穴が多数開いていることがわかった (図5b)。その他にも、細胞内小胞と考えられるものなども観察されたことから、ΔmlaEΔnlpIではPGの穴から細胞内膜や細胞内成分がペリプラズムに流出し、その成分を内包した外内膜小胞(outer-inner membrane vesicles, OIMVs)が放出されたと結論づけられた (図5c)。その結果、細胞質内のGFPもOIMVsに内包されたため、OMVs生産量の増加分以上にGFPの分泌濃度が向上したと考えられる。

3.おわりに
本稿では、大腸菌の遺伝子欠損を重ね合わせることでOMVs高生産株を構築し、タンパク質の分泌生産ツールとして応用できる可能性があることを実証した。さらに、OMVs生産量の増加分以上にタンパク質分泌濃度が増加した原因として、急速凍結レプリカ電子顕微鏡法によって、OMVs高生産細胞に原形質分離が引き起こされ、外内膜小胞が放出されていることなどを明らかにした。今後、細菌が作り出す細胞外ナノ粒子であるOMVsの基礎および応用研究の両方に更なる発展が期待される。
謝辞
本研究の一部は、日本学術振興会による科学研究費補助金 基盤研究Cおよび (公財) 発酵研究所の研究助成により行われた。また研究を実施するにあたり、協力いただいた方々に心よりお礼謝申し上げる。
文献
1) Schwechheimer, C., Kuehn, M. J.: Nat. Rev. Microbiol., 13, 605 (2015).
2) Toyofuku, M., Nomura, N., Eberl, L.: Nat. Rev. Microbiol., 17, 13 (2019).
3) Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A.: Sci. Rep., 6:24866 (2016).
4) Ojima, Y., Yamaguchi, K.: Biotechnol. Prog., 34, 51 (2018).
5) Ojima, Y., Sawabe, T., Konami, K., Azuma, M.: Biotechnol. Bioeng., 117, 701 (2020).
6) Schwechheimer, C., Rodriguez, D. L., Kuehn, M. J.: Microbiologyopen, 4, 375 (2015).
7) Schwechheimer, C., Kuehn, M. J.: J. Bacteriol., 195, 4161 (2013).
8) Roier, S., Zingl, F. G., Cakar, F., Durakovic, S., Kohl, P., Eichmann, T. O., Klug, L., Gadermaier, B., Weinzerl, K., Prassl, R., Lass, A., Daum, G., Reidl, J., Feldman, M. F., Schild, S.: Nat. Commun., 7 , 10515 (2016).
9) Kulp, A. J., Sun, B., Ai, T., Manning, A. J., Orench-Rivera, N., Schmid, A. K., Kuehn, M. J.: PLoS One, 10, e0139200 (2015).
10) Burdette, L. A., Leach, S. A., Wong, H. T., Tullman-Ercek, D.: Microb. Cell Fact., 17, 196 (2018).
11) Ojima, Y., Sawabe, T., Nakagawa, M., Tahara, Y. O., Miyata, M., Azuma, M.: Front. Microbiol., 12:706525 (2021).