【トピックス】
合成ライブラリー法と分子進化法による単ドメイン抗体の産業利用
村上明一、中島雄介
徳島大院・歯、RePHAGEN 株式会社
1.はじめに
特に医薬品領域において「抗体」を基盤とする製品が急増しているが、開発に長期間を要し、高分子であることから生産性や長期保存性に欠けるなど、解決すべき課題が山積している。また、抗体が有する標的分子に特異的に結合する特性を活かした「バイオセンサー」として電子機器に組み込む構想もあるが、生産コストや安定性の面から、未だ困難な状況である。その解決策の一つとして低分子抗体が注目され、抗体工学の発展、特にバクテリオファージや酵母の表面に機能性タンパク質を提示する手法が確立されたことで、その開発が進んでいる。一本鎖Fv (scFv) は、抗原結合部位を形成する2つの抗体ドメインであるVHとVLをペプチドリンカ―で結合した25 kDa程度の低分子抗体であるが、2つのドメイン間の相互作用が弱いこともあり、概して不安定で製品化が難しい。そこで注目されているのが「単ドメイン抗体」である。単ドメイン抗体は、文字通り1つの抗体ドメインが抗原特異性と親和性を発揮するため、その多くは安定性が高く、また15 kDa以下の低分子であることから大腸菌を始めとした下等生物での安価な大量生産が容易である。単ドメイン抗体はラクダ科動物特有のH鎖抗体、もしくは、サメなどの軟骨魚類が有する免疫グロブリン新抗原受容体 (IgNAR) を由来とするが、その多くは標的抗原を動物に免疫する方法で作製されている。なぜなら動物の免疫系をうまく活用することで、標的抗原に対する特異性と親和性が向上した単ドメイン抗体を得ることが可能になるからである。しかし、動物の飼育のみならず、免疫に要する大量の抗原の準備、数か月に及ぶ免疫期間、都度のライブラリー作製、自己抗原と類似した抗原など免疫原性の低い抗原に対しては作製が困難などの問題点がある。また昨今では動物愛護の観点から、動物を使用した抗体作製自体に規制がかかる懸念も生じている。本稿では、抗体工学を駆使した単ドメイン抗体の作製法、さらに、簡便に単ドメイン抗体の親和性・特異性・安定性を向上させる分子進化法に関して報告する。
2.ラクダやサメの特別な抗体
抗体はB細胞が作り出す体液性免疫応答の主役であり、体内に侵入する外来物質に対して抗原特異性が生み出され、これに結合して排除する。一般的な抗体は、2本の重鎖 (H鎖) と2本の軽鎖 (L鎖) から構成され (H2L2型)、それぞれのN末端側に1つずつ存在するドメインは可変領域と呼ばれ直接的な抗原結合を担い、その他は定常領域と呼ばれ抗体のエフェクター機能の発揮や、可変領域の安定な保持に寄与している (図1)。従来は全ての動物がH2L2型抗体のみを保有すると思われていたが、1993年にブリュッセル自由大学のレイモンド・ハマーズ氏のグループが、ヒトコブラクダの血中にH2L2型の抗体に加えて2本のH鎖のみからなるH鎖抗体が存在することを報告した1)。L鎖を持たないH鎖抗体は、そのN末端側にある1つのドメイン (VHH: Variable domain of Heavy chain of Heavy chain antibodyまたはNanobody®) だけで標的抗原に特異的に結合することができ、VHHは単ドメイン抗体として高い安定性や生産性に加え、その抗体工学的応用の容易さからも注目を集めた。しかし、Hamers特許と呼ばれる医薬利用を含めた広範にわたる世界特許2)が出され、その使用が制限されていたことからH鎖抗体に関する研究開発は加速せず、この特許の医薬への独占実施権をもつAblynx社が、長く医薬開発における優位な地位を占めていた。しかし、2013年8月に基本特許が満了した後、多くの医薬品会社に加え、センサー分子を必要とする機器メーカーも興味をもち、開発が進められている。
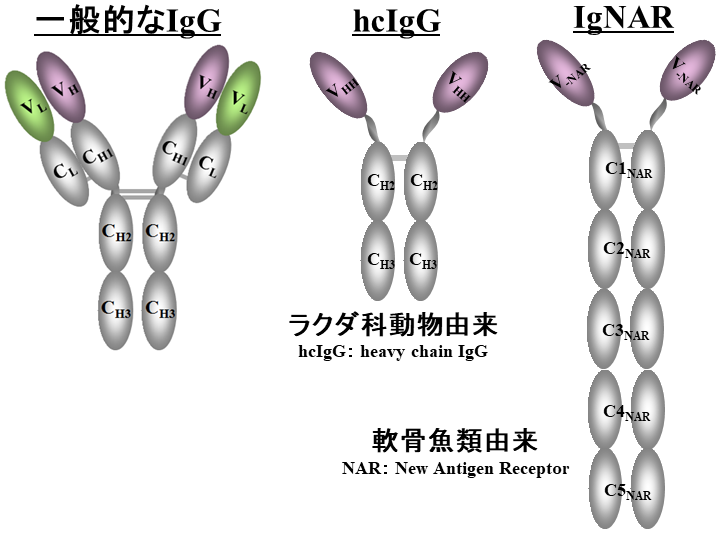
図1 H鎖のみで構成される抗体
H2L2型抗体との存在比率は異なるものの、アルパカ、リャマ、グアナコなど現存する6種のラクダ科動物は全てH鎖抗体を有する。ラクダ科動物以外でH鎖抗体の存在は知られていないが、1995年にマイアミ大学の研究チームにより、コモリザメにもL鎖を持たない抗体が存在することが報告された3)。軟骨魚類に見られる新たな抗体は、免疫グロブリン新抗原受容体 (IgNAR) と呼ばれ、定常領域は5つのドメインから構成される。そのN末端ドメインは、特異なジスルフィド結合の存在や、長い抗原結合ループを有するなど、一般的なVHやVHHとは構造的な相違があるが、VHHと同じく単ドメインで標的抗原に特異的に結合することができ、VNARと呼ばれる。
ラクダ科動物と軟骨魚類だけが単ドメインで結合する抗体を有する理由は、進化の過程において、それらの先祖がL鎖を有する免疫系では対応が難しいストレスに直面した、と考えるのが妥当である。例えばアミロイドーシスなど機能不全になりやすいL鎖変異体の出現やB細胞上のL鎖がウイルスの補助受容体として使用された可能性が仮説として存在する。また、単ドメインであるゆえVH/VLベースの抗体がアクセスできない凹型構造の隠れた標的部位へ結合できたこと、例えば、ウイルスカプシド内部への結合により効率的な抗ウイルス活性を発揮できた事が優位に働いた、などの説が提案されているが、未だ不明である。
逆に、ヒトをはじめ他の生物がH鎖抗体を有さない理由も考察したい。H鎖とL鎖の結合はそれぞれ1つ目の定常領域ドメイン (CH1、CL) が担っており、CH1の欠損によりL鎖を保持できなくなる。ラクダ科H鎖抗体では、ゲノム上のCH1をコードする遺伝子の下流に1塩基の変異があることで正常なスプライシングが起こらず、CH1ドメインが欠失したH鎖を発現し、結果としてL鎖を欠いたH鎖抗体となる。この1塩基の変異は他の生物でも進化過程で起こり得た可能性が高いことから、H鎖抗体には他の生物に採用されない短所が存在することになる。生体における抗体の多様性形成メカニズムは、ゲノム上に複数存在するV (D) J遺伝子の再構成と、そのつなぎ目へ塩基の挿入や欠失、そして、再編成を終えたH鎖とL鎖のランダムなペアリングによる。つまり、L鎖を持たないことで多様性形成メカニズムの1つが働かないことは短所となり得る。さらに、H2L2型抗体はVH、VL由来の各3つ、計6つの相補性決定領域 (CDR) を有し、協同的に抗原と接触するが、H鎖抗体は3つのCDRしか持たないことから親和性が低くなる可能性が考えられる。しかしH鎖抗体ではCDRに加えてドメイン構造を保持するフレームワークも活用した抗原結合により十分な親和性を獲得していることが報告されており4)、現にH2L2型抗体と同等の親和性を有するVHHが数多く得られていることから短所とは言い難い。一方で、我々がVHHを作製する際に困難に直面する場合、その標的抗原の多くに共通する性質が「低分子」である。図2に示した通り、H2L2型抗体が抗原と結合する際、比較的分子量の大きな抗原は面型や進展型の結合様式をとる5)。しかし低分子抗原に対してはVHとVLドメインの間に抗原結合ポケットを構成し、水素結合、ファンデルワールス力、疎水結合、静電気力など、複数の非共有結合を形成する事で高い親和性を獲得する。単ドメイン抗体においても、3つのCDRのループがポケット様に開いた抗原結合部位を形成して低分子抗原に結合する報告があるが、非常に稀である6)。すなわち、低分子から高分子まで、多様な抗原への対応は2つのドメインによる抗原結合部位の形成の方が優位であると言える。しかし、このような単ドメイン抗体の欠点を理解したうえで、その高い安定性、生産性、抗体工学的改変の容易さなどの利点を活かすことで、より広く単ドメイン抗体が活躍する場が生まれると期待される。
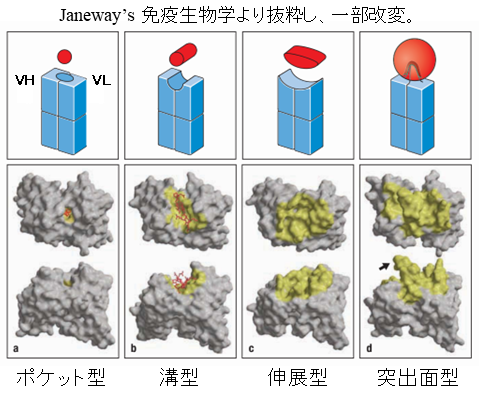
図2 抗体と抗原の結合様式
なおH2L2型抗体のVHとVLの相互作用はその結合面に存在する疎水性アミノ酸残基に依存しており、VHHではそれらが親水性残基に置き換わっていることで単ドメインでも可溶性を保持していると言われていた。しかし、VH同様に疎水性残基のままであるにも関わらず可溶性を保持するVHHが数多く存在することから、これは必須条件ではないと考えられる。
3. VHHライブラリーの作製戦略とスクリーニング
一般的な完全ヒト抗体の作製に使用されるscFv抗体ライブラリーの多様性は、通常、複数のヒトの血液サンプルからVH鎖遺伝子とVL鎖遺伝子をそれぞれ増幅し、それらをランダムにペアリングする事により創生される。単ドメイン抗体ではこの戦略が適用できないため、筆者らは1つのVHHを足場 (スキャホールド) とし、CDR3領域遺伝子を人工合成したライブラリーを作製した。人工合成遺伝子としては、全20種のアミノ酸残基をランダムにコードし、かつ、アンバーコドンTAGを終止コドンでなくグルタミンに翻訳するSupE変異大腸菌株において終止コドンを含まない、17残基から成るCDR3コード配列 (NNK) x17を合成してライブラリーを構築した。しかし、本ライブラリーから得られるVHH抗体は特異性が低く、解離定数Kdが数µM以上の低親和性のクローンしか得られなかった。この理由は、限定されたCDR3長やCDR3に適さない残基の高頻度な出現など、数多く考えられた。そこで、ライブラリーの構築法をscFvの作製戦略に類似した方法に変更した。すなわち、複数のラクダ科動物アルパカの血液からVHH遺伝子を増幅し、その遺伝子断片を5’側のFR1-CDR1-FR2-CDR2-FR3を含む断片と、3’側のFR3-CDR3-FR4を含む断片に分け、改めてそれらをランダムにペアリングした (図3)。それらの結合VHH遺伝子断片をM13ファージのgIIIタンパク質との融合タンパク質としてファージ表面に提示するためファージミドベクターに挿入し、大腸菌HST02株に形質転換した。得られたコロニー数は約400億あり、これらのコロニーをランダムに選択してVHHクローンのアミノ酸配列を解析した (図4)。その結果、CDR3の長さは5~21アミノ酸残基と多様であること、CDR領域は勿論、フレームワーク領域にも多くの体細胞超突然変異由来と考えられる変異の導入が確認され、多様性に富むライブラリーであることが示唆された。
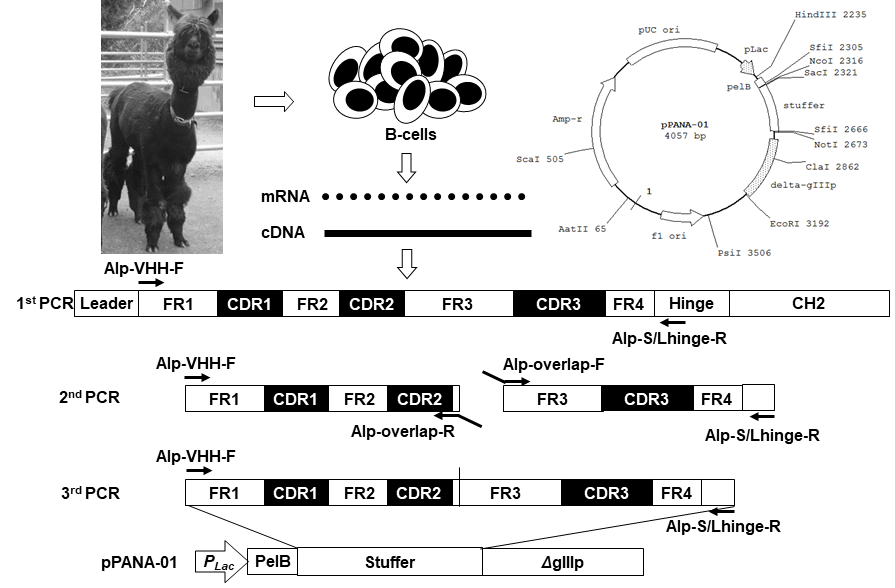
図3 VHHライブラリーの多様性創製戦略

図4 ランダムに選択したVHHのアミノ酸配列
ファージライブラリーからの抗原結合VHHの選別には、一般的なパニング法を使用している。すなわち、マキシソープ処理が内壁に施されたイムノチューブに抗原タンパク質を固定し、スキムミルクでブロッキングした後にファージライブラリーを加え、非結合性ファージを洗浄除去した後に結合性ファージをアルカリ溶出させる。中和後に大腸菌と混合することで感染させ、抗体遺伝子を大腸菌に移す。この操作を通常2~3ラウンド繰り返すことにより結合性クローンを濃縮し、最終的に単クローン化する。本法により、動物免疫を必要とせず、微量の標的抗原 (0.1 mg以下) があれば平均10日間で特異的なVHH遺伝子を同定することができる。また、得られたVHHは、大腸菌発現系を使用して安価かつ大量に生産することが可能であり、実験室レベルでも100 ml程度の培養で数十 mgのVHHタンパク質を生産できる。構築したライブラリーから既に、心筋梗塞のマーカーとなるトロポニンT/I、がん関連因子のHER2やEGFR、感染症関連のインフルエンザウィルスやノロウイルス由来タンパク質など、100種を超える多様な抗原に対してVHHを作製できることを実証しており、Kd値が数~数十 nMレベルの高い親和性のクローンも得られている (図5)。
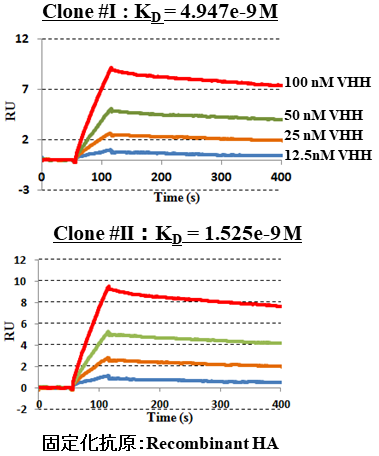
図5 ヘマグルチニンタンパクに対するVHHの親和性
4.VHHの高性能化技術
動物免疫で得られた抗体であっても、ライブラリー法から得られた抗体であっても、その利用・応用に際して十分な性能であるとは限らないことから、分子進化工学による取得抗体の高性能化技術は非常に有用である。筆者らは、上述のファージ提示法と酵母提示法を組み合わせて使用することで、安定性、特異性、親和性の高いVHHクローンを選別している。ファージ提示法に使用している線維状ファージM13株はpH変化に強く、80度で2時間の加熱、4M尿素や1% Triton-X 100などのタンパク質変性剤に曝してもその感染力を失わない。すなわち、パニング法が成立することから、これらの条件にライブラリーを一旦暴露させることで、安定性の高いVHHを取得することが可能になる。VHHの熱安定性はクローンによって大きく異なり、60度程度の加熱により結合能を失うクローンもある一方、ライブラリーを加熱して選別することにより、100度に加温しても室温に戻せば結合能を完全に回復するクローンが取得できている。
ファージ提示法を用いたスクリーニングは、標的抗原に結合するかしないかの選別であり、スクリーニング時に使用する抗原量を変化させたとしても、数十 µM程度の親和性があれば陽性になるため、親和性を向上させるシステムとして使用するのは困難である。一方、酵母提示法は、各酵母の表面に提示されたVHH量と、それらVHHが結合した抗原の結合量の2つのパラメータを使用してセルソーターにより分取できることから、親和性が向上したクローンの取得に有用である。加えて、標的抗原と結合すべきでない分子を異なる蛍光色素でラベルすることで、標的抗原にのみ特異性高く結合するクローンの分取が可能になる。
高性能化ライブラリーの作製には2つの方法を使用している。上述のように、我々のライブラリーにおいては、VHH遺伝子の前半と後半を一旦分離し、それらのランダムなペアリングにより多様性を創生した。11頭のアルパカ由来の血液から調製した約1億 (~1x108) 種のVHH遺伝子を起点に使用したことから、約1016種の遺伝子的なVHHの多様性が創生されたことになる。しかし、ファージライブラリー化のボトルネックになる大腸菌への形質転換の必要性により、ファージライブラリー化したのは1010種程度である。すなわち、より最適なペアが存在する可能性が高いと考え、高性能化を行うVHH遺伝子のCDR3を含む後半部分を残し、新たに約8億種の前半部分とペアリングしたライブラリーを作製してスクリーニングを行った。これにより100倍程度親和性が向上したクローンが1週間程度で取得でき、本法を「CDR3温存法」と呼んでいる。更に親和性の高いクローンの取得が必要な際には、一般的に使用されているランダム変異導入ライブラリーを構築してスクリーニングを行うことで、Kd値がnMレベル以下の非常に高い親和性を有するVHHが得られる。これら一連の高性能化技術は、取得したVHHのヒト化技術としても有用である。
5.おわりに
上述したとおり、人工的に多様性を創生したVHHライブラリーからのスクリーニングにより、任意の抗原に対して迅速にVHHを作製することが可能であり、使用用途に応じて取得VHHの性能を向上させることができる。その活用例として、2019年末に発生した新型コロナウイルスに対してもVHHを作製し、世界の研究者に無償で提供した。まずGenBankのSARS-CoV-2のゲノム塩基配列 (NC_045512.2) 情報をもとにスパイクタンパク質S1サブユニット遺伝子を人工合成し、レセプター結合ドメイン (RBD) 領域を大腸菌で融合タンパク質として発現・精製して標的抗原として19種類のVHHクローンを取得した。さらにCDR3温存法による高性能化を経て、培養細胞由来の完全長S1サブユニットタンパク質への結合を確認したうえで提供したが、これら一連の作業に要した時間は約1.5か月であった (図6)。すなわち、抗原の遺伝子情報さえ入手できれば迅速にVHHが作製でき、今後の感染症対策の一助となることを期待している。近年、初のVHH医薬品であるCaplacizumabが承認されたことも追い風になり、CAR-T細胞治療における既存scFvからVHHへの置き換えも検討されている。高い安定性と生産性を特徴とするVHHが、ヒトの医療用にとどまらず、畜産業、水産業、さらには、電子機器のセンサーとしてなど、広く活用されることを願い、2018年にRePHAGEN株式会社を設立し、より多くのVHHを提供できる体制を整えた所である。
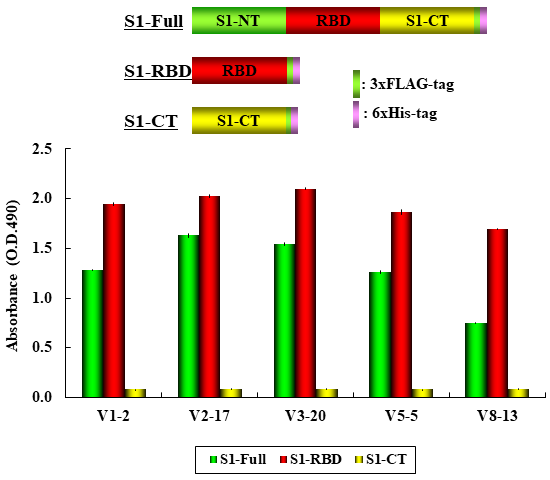
図6 SARS-CoV-2 VHH抗体の特異性評価
謝辞
本項で紹介した研究の一部は、沖縄県が実施する沖縄科学技術イノベーションシステム構築事業 (H27~29年)、および、沖縄感染症研究成果活用促進事業 (H30~R3年) の支援による成果です。
文献
1) Harmsen, M. M., De Haard, H. J.: Appl. Microbiol. Biotechnol., 77, 13 (2007).
2) Cecil, C., Raymond, H.: WO1994004678(1994).
3) Andrew, S. G., David, A., Marianne, H., Austin, H., McKinney, E. C., Martin, F. F.: Nature, 374, 168 (1995).
4) Laura, S. M., Lucy, J. C.: Proteins, 86, 697 (2018).
5) 笹月健彦: Janeway’s 免疫生物学, 7, 121 (2010).
6) Sean, W. F., James, R. H.: Protein Sci., 20, 1196 (2011).