【トピックス】
微生物由来の有機触媒 〜第三の生体触媒〜
西山辰也、上田賢志、橋本義輝、小林達彦
日大・生資科、日大・生資科、筑波大・生命環境系/微生物サステイナビリティ研究センター、筑波大・生命環境系/微生物サステイナビリティ研究センター
1.はじめに
1-1 触媒の歴史
触媒は大きく無機触媒 (主に金属触媒)、生体触媒、有機触媒に分けることができる。1836年にスウェーデンの化学者Berzeliusが化学反応に現れない第三の物質が反応を促進する現象をCatalysis (触媒作用) と呼んでおり、これが科学に触媒という概念を生み出した瞬間とされている。その後、ドイツの化学者Ostwaldが触媒を「特定の化学反応を促進し、自身は変化しない物質」と定義し、今に至っている。中でも金属触媒は20世紀における大発明の一つとされ、様々な研究開発が行われ現在の化学合成の大部分を担っている。
生物がもつ触媒は生体触媒と呼ばれる。最も知られるものは酵素だ。ものづくりへの利用という点では金属触媒よりも酵素の方が歴史は長い。紀元前3~4000年ごろ、人類がビールの原型を造る際に用いたのが最初とされており、その他にはパン、ワイン、味噌、納豆といったいわゆる醗酵において利用されている。酵素が初めて物質として単離されたのは1833年であり、フランスのPayenとPersozの業績である。1876年にはKuehneによって、生体から得られた触媒作用を示す物質がEnzymeと命名され、その正体がタンパク質であるという証明は1926年にウレアーゼの結晶化に成功したSumnerによる。
1-2 有機触媒とは
有機触媒とは触媒活性を有する金属を含まない低分子有機化合物のことで、2000年にMacMillanによって定義された新しい触媒である1)。昨年 (2021年) は、有機触媒の第一人者であるMacMillanとListがノーベル化学賞を受賞し、有機触媒が一層の脚光を浴びた記念すべき年になった。二人は同じ年に異なる不斉合成 (光学異性体を作り出す反応) を触媒する有機触媒を別々に発見している1,2)。
実はこの有機触媒は1971年にUlrichらによって発見されており、最初の有機触媒として発見されたのはタンパク質を構成するアミノ酸の1つのL-プロリンである3)。この時は金属触媒の勢いに圧され、その後しばらくは有機触媒に関する論文は登場していなかったが、2000年以降増加の一途をたどっている (たった7年で論文年間掲載件数が500報を超えるなど)4)。
有機触媒がこれほど注目されるのには理由があり、工業で一般的に用いられている金属触媒と比較して以下の点で優れているためである。有機触媒は反応生成物に金属の混入が無いだけでなく、廃液の処理等にも金属が含まれないので低コスト化できる。反応条件が温和であり、水溶液中でも触媒作用を示し、常圧〜数気圧で進行し、反応温度も常温であることが多い。これらは環境負荷が小さく、SDGsやグリーンケミストリーの推進が叫ばれている昨今の状況と相まっている。加えて、貴重な金属を使わずに安価に研究・開発が可能であることから、新興国 (特に中国) での研究対象になりやすいことも理由とされている。
1-3 有機触媒の利用
光学異性とは、よく掌で例えられることの多い化合物同士の関係のことである。中心の原子から見ると同じ置換基をもつものの、3次元の立体構造で考えると鏡に写したように重ね合わせることができない化合物を光学異性体という。L体、D体が存在するアミノ酸がその代表である。光学異性体の生理活性は異なることがあり、例えば旨味成分のL-グルタミン酸はD体では無味である。生物を構成するタンパク質のほぼ全てはL-アミノ酸でできていることは周知の事実であり、多くの酵素が光学異性体を認識し、我々はそれを基質特異性という酵素の一性質として受け入れている。つまり酵素は優れた不斉合成反応の触媒として捉えることができる。
しかし、不斉合成反応が酵素の独壇場かといえば実はそうではない。それが2001年にノーベル化学賞を受賞した野依良治教授の研究で知られる遷移金属錯体の触媒である。この金属触媒は、ケト基をヒドロキシル基に還元する不斉合成反応を触媒する。化学合成では光学異性体のどちらかのみを合成するのは困難であった。しかし、これらを分けて合成することの重要性が近年は高まっている。そのため、この触媒は非常に高く評価され、酵素と同じく工業で広く用いられている。そのような中で、同じく不斉合成反応を触媒する有機触媒は、金属触媒にはない利点を生かすことで利用が始まっている。
本稿では、偶然にも生物から発見した有機触媒について紹介する5)。
2.有機触媒 アクチノロージン
2-1 アクチノロージンの再発見
当初我々は、新規のオキシダーゼ (酸化酵素) の探索をテーマに研究を開始した。いくつかの化合物を基質に用いて酸化活性を測定していたところ、一部の放線菌がL-アスコルビン酸とL-システイン (L-Cys) に対して高い酸化活性を示すことを見出した。中でもモデル放線菌として扱われているStreptomyces coelicolor A3(2)は高い活性を有しているだけでなく、その活性は熱耐性 (70℃で30分間熱処理しても失活しない) を示したことから、バイオセンサーへの利用が可能であると期待した。バイオセンサーとは生体物質または細胞を利用し特定物質の測定を行う化学センサーの1つである。これにはセンシングに関わる活性物質の高い安定性が求められる。
当時、すでにS. coelicolor A3(2)のゲノム情報が解読されていたため、本菌を研究対象として目的酵素の純化を目指した。SDS-PAGEと酸化活性を指標として、硫酸アンモニウムによる分画、各種カラムクロマトグラフィーにより培養上清から精製を実施した。しかし、精製の終盤で目的酵素を見失ってしまった。酵素精製を行ったことのある方はお分かりかと思うが、基本的にはSDS-PAGEのゲル上に見られるタンパク質のバンドの濃淡は活性の強弱と一致する。しかし、何度精製を重ねてもSDS-PAGE上で目的酵素と思われるタンパク質のバンドを見つけることができなかった。
酵素精製が失敗に終わったかと思ったのだが、我々はあることに気がついた。S. coelicolorは二次代謝産物としてベンゾイソクロマンキノン系抗生物質であるアクチノロージン (ACT) を生産することがよく知られており、その生合成経路の研究は盛んに行われている (図1)6)。酵素活性をもつ画分はACTに由来すると思われる紫色を呈していたが、その色の濃淡と活性の強弱とが一致したのである。そこで、本活性が酵素によるものではなく、ACTによるのではないかと仮説をたて、武蔵野大学・市瀬先生、田口先生から分与いただいた精製ACTを用いて活性測定を行った。その結果、驚くことにACTにL-アスコルビン酸とL-Cysの酸化活性が見られた。
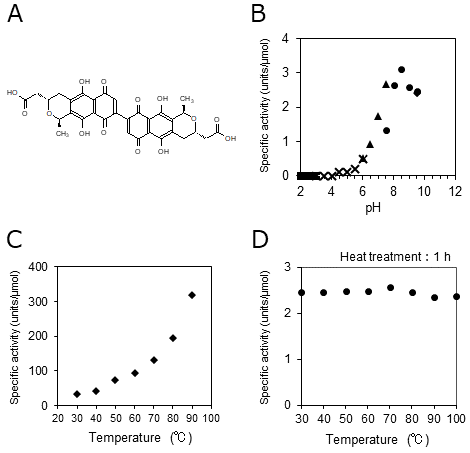

既述であるが、金属分子を含まない低分子有機化合物の触媒が有機触媒である。そこで、本当にACTが有機触媒であるかを確認した。過剰量のL-アスコルビン酸と酸素に対し、少量のACTを添加するとACTに対してモル比で100倍以上の酸素の減少が見られた。LC-MS/MSによる定量解析では反応の前後でACTの量に変化がないことが判明した。さらに、金属分析からはACT溶液には金属が含まれないことも示された。以上の結果から、ACTは①金属分子を含まない、②低分子有機化合物であり、③触媒活性を有することが示されたため、ACTは有機触媒であることが明らかとなった。
それまで、生体触媒・金属触媒に次ぐ第三の触媒として注目された有機触媒は、生命現象に関与する生体触媒とは独立した存在として扱われていた (L-プロリンに関しても生体内の生理条件下での反応系ではないため)。しかし、ACTが有機触媒であるという発見は、有機触媒も生体触媒として機能している可能性を強く示唆しており、酵素・リボザイムに次ぐ第三の生体触媒として位置づけられることを意味している。2-2 アクチノロージンの有機触媒としての性質次に、我々はACTの触媒としての諸性質を調べた。その結果、触媒している反応式はL-アスコルビン酸+O2→L-デヒドロアスコルビン酸+過酸化水素(H2O2)、2L-Cys+O2→L-シスチン+H2O2と判明した。また、これら2つの基質以外にも、L−システアミンやジチオスレイトール、還元型グルタチオンなど、チオール基をもつものにも活性を示した。至適pHは8.5であると判明した。一方で、熱安定性や至適温度を調べると、酵素とは異なり100℃で1時間熱処理しても失活せず、また温度の上昇にともなって指数関数的に活性が上昇した (図1)。
さらに我々は、生物の生産する有機触媒が他にもあるはずと考え、天然物の化合物ライブラリーから有機触媒の探索を実施した。2,242種類の化合物を調べたところ、3種類の植物由来の化合物にもL-アスコルビン酸を酸化する活性が認められ、有機触媒が天然にも広く存在する可能性が示唆された (図2)。
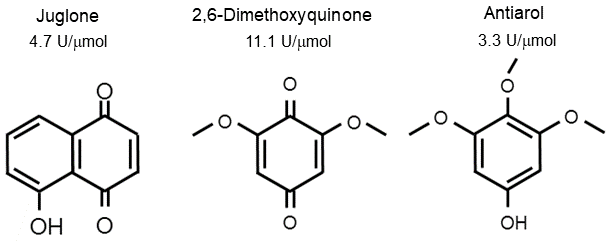
図2 植物由来の3つの有機触媒
2-3 有機触媒の触媒作用機序
では、なぜACTは触媒作用を有するのか。我々はその作用機序に興味をもった。微生物由来の有機触媒と、植物由来の3種の有機触媒とで共通するのがキノン構造である。キノン化合物は生体内ではキノンレドックスサイクルと呼ばれる反応を行う (図3)。これは還元型であるヒドロキノンがシトクロムcレダクターゼによりキノンラジカル中間体を経てキノンに酸化され、キノンはキノンレダクターゼによりキノンラジカルを経てヒドロキノンに還元される、という循環機構である。キノンサイクルは、例えば電子伝達系などで見られる反応系である7)。
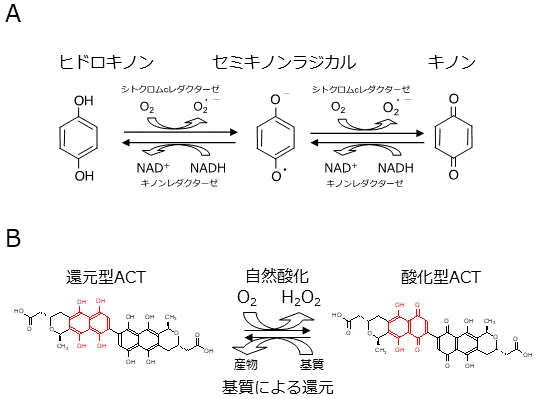

おそらく、ACTもこのキノンレドックスサイクルによる酸化還元を繰り返しているものと我々は考えている。すなわち、還元型のACTは酸素分子により酸化され、酸化型 (キノン) ACTになり、基質のL-アスコルビン酸やL-Cysの還元力で再び還元型 (ヒドロキノン) になるというものである。このメカニズムであるとすると、基質が還元力をもつものであることも理解できる。生体内で見られるキノン (または生体内のキノンレドックスサイクル) との大きな違いは、ACTは酵素を必要とせず、自然酸化による酸化と、基質による還元でキノンレドックスサイクルを行う点である (図3)。
2-4 有機触媒が示す新たな抗菌作用機序の可能性
ACTは、抗菌活性を示す抗生物質であるが、その詳しい作用メカニズムは不明である。我々は、上記の発見に基づき、ACTの触媒作用によって生成される産物のH2O2に着目した。L-アミノ酸オキシダーゼはL-アミノ酸の酸化反応を触媒し、H2O2を生成する酸化酵素である。この酵素は魚の粘膜中に存在し、生成するH2O2で菌から自身を守っているとされている8)。それと同様に、ACTの抗菌活性の作用機序は、触媒作用によって生産するH2O2が原因ではないかと推測した。
そこで、これを証明すべくカタラーゼ (過酸化水素分解酵素) を用いた実験を行った。H2O2には、特にDNAに損傷を引きおこすことを通じて生物を死に至らせる効果がある。ACT感受性として報告のあるStaphylococcus aureusを寒天培地に塗り広げ、一方にはACTのみ、もう一方にはACTとカタラーゼを染み込ませたペーパーディスクを置き、形成された阻止円を調べたところ、カタラーゼ添加区において阻止円が小さくなった (図4)。すなわち、ACTの抗菌活性はカタラーゼで軽減されるということである。同様の効果は、液体培養でも認められたことから、有機触媒作用によって生じたH2O2が抗菌活性の本体である可能性が支持された。

図4 ペーパーディスク法を用いたアクチノロージンの抗菌活性試験の結果
これまで知られている抗菌活性の作用機序は、タンパク質合成阻害、細胞膜変質、細胞壁合成阻害、DNA合成阻害、RNA合成阻害、葉酸代謝阻害の6種類である。一方で、ACTの抗菌活性作用機序が有機触媒としての触媒作用により生成するH2O2によるものであるなら、これは抗菌活性の新たな作用機序と言えるのではないだろうか。
3.アクチノロージンに続く微生物由来有機触媒の発見
さらに我々は、微生物由来の有機触媒を探索した。その結果、これまでにL-アスコルビン酸や、L-システインの酸化反応触媒活性を有する土壌由来の放線菌が複数株得られていることから、これらの酸化反応を触媒する有機触媒は広く存在すると考えられる。中でも、Streptomyces vietnamensisの培養上清からはACT以上のより強い活性が見られた。本菌はグラナチシン (GRA) を生産することで知られる。GRAもACT同様にキノン骨格を有する抗生物質であることから、本化合物も有機触媒である可能性が高まった。GRAを精製し、活性測定及びLC-MSによる定量解析、ICP発光分析装置での金属分析を実施したところ、触媒量での酸化活性が見られ、反応によるGRAの減少は見られず、金属を含まないことが示された。これによりGRAは有機触媒であることが判明し、微生物由来の有機触媒としてはACTに次いで二例目の発見となった。
グラム陽性の土壌細菌である放線菌は、多彩な二次代謝産物生産能をもつことで知られる。放線菌からは10,000種類を超える生理活性物質が発見され、微生物全体の45%になると言われるほどである9)。また、放線菌の二次代謝産物には、抗菌活性以外にも抗腫瘍活性をはじめとする様々な活性をもつものも存在することが知られ、今なお広く注目を集めている。今回見いだされた有機触媒活性とそれに基づく新しい抗菌メカニズムは、放線菌が作り出す二次代謝産物にさらなる可能性が潜在していることを強く示唆している。
4.終わりに
触媒は、我々の生活を支える重要な物質である。アンモニア合成で知られるハーバー・ボッシュ法の鉄触媒は人類を飢餓から救ったと言え、コロナウイルスのPCR検査にはDNAポリメラーゼが欠かせない。
本稿では、微生物が作る有機触媒を紹介させていただいた。生物由来の有機触媒は、大気圧下、室温で十分な酸化活性を示す点では酵素と同様であるが、反応温度の上昇に伴い活性が上昇する点と、高い熱安定性を示す点では、酵素には見られない特長を有することから、その利用性は今後さらに拡大していくことと考えられる。
これまで、触媒化学の領域では、金属触媒や有機触媒は人の手によって様々な種類が生み出されてきた。一方、酵素は生物から探索するのが一般的であり (もちろん一部はそれを人為的に改変している酵素もあるが)、特に微生物に新しい酵素を求める研究は農芸化学を中心に我が国で大いに発展を遂げて今に至る。今回の発見は、酵素と同様に新たな有機触媒を生物から探索する研究が生まれることを期待させる。
謝辞
精製アクチノロージンを分与くださった市瀬浩志教授および田口貴章先生に深く感謝申し上げます。
文献
1) Ahrendt, K. A., Borths, C. J., MacMillan, D. W. C.: J. Am. Chem. Soc., 122, 4243 (2000).
2) List, B., Lerner, R. A., Barbas, C. F.: J. Am. Chem. Soc., 122, 2395 (2000).
3) Eder, U., Sauer, G., Wiechert, R.: Angew. Chem. Int. Ed., 10, 496 (1971).
4) MacMillan, D. W. C.: Nature, 455, 304 (2008).
5) Nishiyama, T., Hashimoto, Y., Kusakabe, H., Kumano, T., Kobayashi, M.: Proc. Natl. Acad. Sci. USA, 111, 17152 (2014).
6) Okamoto, S., Taguchi, T., Ochi, K., Ichinose, K.: Chem. Biol., 16, 226 (2009).
7) Davies, K. J., Doroshow, J. H.: J. Biol. Chem., 261, 3060 (1986).
8) Kitani, Y., Tsukamoto, C., Zhang, G., Nagai, H., Ishida, M., Ishizaki, S., Shimakura, K., Shiomi, K., Nagashima, Y.: FEBS J., 274, 125 (2007).
9) Bérdy, J.: J. Antibiot., 58, 1 (2005).