【トピックス】
直接電子移動型グルコース脱水素酵素の創出
島﨑 (奥田) 順子
ノースカロライナ大学チャペルヒル校・BME
1.はじめに
直接電子移動型の酵素を用いる第3世代型と呼ばれる電気化学的酵素センサの測定原理は、従前の原理に基づく酵素センサに比べて種々の利点を有することから、その応用が期待されている。本稿では、まず、直接電子移動型酵素センサの利点に関して述べる。その上で、直接電子移動型酵素の例とその改変、及び、非直接電子移動型酵素から直接電子移動型酵素への改良に関する著者らの成果を紹介する。
2.直接電子移動型酵素センサ
電気化学的酵素センサ (以下酵素センサ) は、酵素の基質特異的な酸化還元反応と電極反応とを組み合わせ、酵素の基質である測定対象を検出する装置である。酸化還元酵素を用いる酵素センサの測定原理は、酸化的半反応において用いる電子受容体の違いにより、第1世代から第3世代に大別される。第1世代型の酵素センサでは、グルコース酸化酵素(GOx)に代表される酸化酵素の酸化的半反応において、酸素を電子受容体として、その反応で生じた過酸化水素、あるいは消費される酸素濃度の減少量を測定する。これに対して、第2世代型では、酸化酵素および脱水素酵素において、酸化的半反応における電子受容体として、人工電子受容体を用いる。第3世代型では、酸化還元酵素が酸素を含めた外部電子受容体を介さずに、酵素 (補酵素) 自身が電極と直接電子授受を行うことで、酸化的半反応を進め、基質濃度の測定を行う。
直接電子移動型酵素を用いた酵素センサでは、電極に印加する電位は、電極との電子移動に関係する補酵素の酸化還元電位に依存する。第1世代型で検出に用いられる過酸化水素や、第2世代型センサで用いられる人工電子受容体の酸化還元電位に比べて、直接電子移動型グルコース脱水素酵素 (GDH) の電子伝達サブユニット中のヘムの酸化還元電位ははるかに低く、このため応答電流測定時の印加電位を低く設定できる。低電位での測定では、測定試料中に存在する還元性の夾雑物質の影響が軽減できる。したがって、夾雑物質の干渉を低減するための電極表面処理等の酵素センサの構造ならびに製造プロセスの簡略化が可能となる。また、直接電子移動型酵素を用いた第3世代型酵素センサでは、酵素のみで電気化学的シグナルを生成し、人工電子受容体や酸素を電子受容体として必要としないため、測定対象の検出までの反応の行程数が少なく、製造工程を単純化できる。これら、センサを作製する際に直接電子移動型酵素を用いることによる、製造工程と電極表面処理の簡略化が可能であるという点は、補酵素を結合した導電性ポリマー上に酵素を再会合させるなど複雑な工程を必要とする「ワイヤードエンザイム」技術等の他の直接電子移動を指向した方法と比較して大きな利点といえる。さらに、一般的に生体に有害な物質である金属錯体等の人工電子受容体を要しないことから、生体内での連続計測等に対して理想的である。
以上述べたような利点が注目され、直接電子移動型の酵素を用いた第3世代型酵素センサの構築が期待されている。電極との直接電子移動が可能な酵素として、複数の酸化還元中心を有する酵素が挙げられる1)。我々はその中で、触媒サブユニット/ドメインとヘムを有する電子伝達サブユニット/ドメインからなるGDHに着目し、直接電子移動型GDHを用いた第3世代型センサの構築の検討を行なってきた。次項では、直接電子移動型GDHに対する電子移動能の改変に関する成果を示す。また、天然に存在する直接電子移動型酵素の種類は限られているため、非直接電子移動型の酸化還元酵素を用いて、直接電子移動型酵素を創出した成果に関しても紹介していく。
3-1 直接電子移動型酵素の改変
Burkholderia cepacia由来グルコース脱水素酵素 (BcFADGDH) は、フラビンアデニンジヌクレオチド (FAD) と鉄硫黄クラスターを有する触媒サブユニット、tatシグナルにより触媒サブユニットのヒッチハイカーとして機能する小サブユニット、3分子のヘムcを有する電子伝達サブユニットからなるヘテロトリマーを形成する (図1a)。これまでにEwingella americana由来FADGDHが同様のヘテロトリマー構造を有するGDHとして報告されている他、Gluconobacter japonicus由来フルクトース脱水素酵素 (FDH) 等のヘテロトリマー酵素が確認されている。BcFADGDHの電子伝達サブユニットは電極との直接電子移動を示すため、この酵素は代表的な直接電子移動型の酵素として認識されている1-8)。
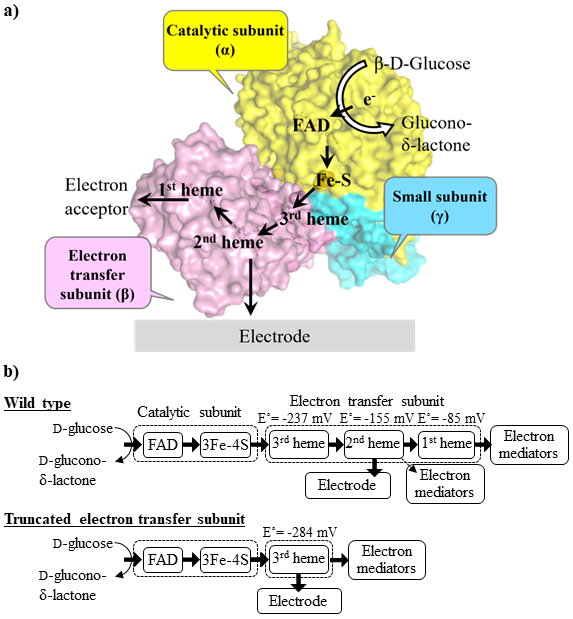

酵素と電極との直接電子移動による電流をシグナルとして検出する測定においては、酵素の酸化還元中心の酸化還元電位が測定時の印加電位を決定する要素となる。脱水素酵素を用いた測定対象の酸化に基づくセンサにおいては、測定時の印加電位が高いと、測定対象中の還元性の夾雑物質が電極と反応することによりセンサの正確性が低下する。そのため、測定時の印加電位は低いことが望ましい。BcFADGDHの直接電子移動型酵素としての改良を目指し、その酸化還元電位に着目した。BcFADGDHでは、触媒反応で生じた還元型FADから鉄硫黄クラスターを介して電子伝達サブユニットへ電子移動する9)。電子伝達サブユニット中では、C末端側の3番目のヘムが鉄硫黄クラスターから電子を受け取り、その後2番目、1番目のヘムへと電子が移動する。人工電子受容体を用いた溶液中における酵素活性測定においては、1番目のヘムが電子受容体との電子の受け渡しを担うが、電極との直接電子移動では、2番目のヘムが電極との電子移動を担っていることが示唆されている10) (図1)。すなわち、電極との直接電子移動に際して、触媒サブユニットの活性中心から電極への電子移動に関与するのは、2番目、および3番目のヘムである。そこで、本酵素を用いた直接電子移動の際の印加電位を下げるため、電子伝達サブユニットの3分子のヘムのうち、最も上流に位置するC末端側の3番目のヘム周辺のドメインのみとした電子伝達サブユニットを有する改変酵素を構築した11)。その結果、改変酵素は酵素活性を維持し、直接電子移動能を有した状態で組換え発現することができた。さらに、3番目のヘムの酸化還元電位に関して検討を行ったところ、3分子のヘムを有する野生型の電子伝達サブユニット内における酸化還元電位よりも、卑側にシフトした酸化還元電位を示した (図1b)。この酸化還元電位の低下により、低印加電位による測定が可能となると考えられた。
BcFADGDHと類似したヘテロトリマー構造を有するFDHに関して、他の研究グループから電子伝達サブユニットのヘムドメインの改変の報告も行われている12)。FDHの電子伝達サブユニットの1番目、2番目のヘムドメインを削除した変異体では、基質存在下におけるCV測定でのオンセットポテンシャルが、野生型の酵素に比較して卑側にシフトしていた。この報告は、直接電子移動型酵素の電子伝達サブユニットに対する改変によって、より低電位での応答電流測定が可能であるとする、我々の検討結果と一致するものであった。
3-2 タンパク質工学的手法による直接電子移動能の付与
FADやピロロキノリンキノン (PQQ) を補酵素とする非直接電子移動型のグルコース脱水素酵素に関して、電子伝達に関与するドメインをタンパク質工学的に融合することによって直接電子移動を達成した例を紹介する。
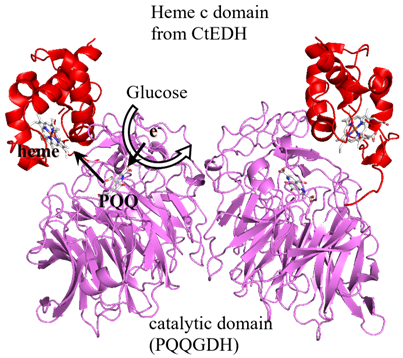
Acinetobacter calcoaceticus由来水溶性グルコース脱水素酵素 (AcPQQGDH) はPQQを補酵素とし、βプロペラ骨格構造をとる (PDB:1CQ1)。シトクロムが電極との直接電子移動を示すこと、および、ウマ由来シトクロムc、あるいは大腸菌由来シトクロムb562 (Cyt b562) とAcPQQGDHを電極上に共固定することにより、外部電子受容体のない状態で酵素反応の電極応答を観察できたこと13,14)から、AcPQQGDHに対してシトクロムを融合することで電極に対する直接電子移動能を付与できるものと考えた。そこで、AcPQQGDHに対して直接電子移動能を付与することを目的として、ヘムcドメインを付与することとした。Comamonas testosteroni由来エタノール脱水素酵素(CtEDH)はAcPQQGDHと同様にPQQを補酵素としβプロペラ構造を示す触媒ドメインと、C末端側のヘムcドメインを含む電子伝達ドメインがリンカーでつながった特徴的な構造を有するキノヘモプロテインとして知られている(PDB:1KB0)。このCtEDHのヘムcドメインを、ドメイン間リンカーを含めてAcPQQGDHに融合した酵素、キノヘモプロテイングルコース脱水素酵素を構築した (図2)15)。構築したヘムcドメイン融合AcPQQGDHは、大腸菌由来のシトクロムc成熟遺伝子オペロン、ccmABCDEFGH遺伝子を共発現した大腸菌において活性を維持して発現し、且つ、基質の添加によるヘムcの酸化還元に由来する吸光スペクトル変化を示した。このことは、酵素反応により還元されたPQQからヘムcへの電子授受が行われることを示唆している。このヘムcドメイン融合AcPQQGDHを電極に固定して、基質添加による応答電流の測定を行った結果、基質濃度依存的な電流値の変化が観察され、電極との直接電子移動が確認された。融合酵素の発現に関しては、CtEDH、AcPQQGDHともにsecシグナルにより発現するため、大腸菌内でヘムcを有する状態で発現できたものと考えられる。BcFADGDHでは、触媒サブユニットが小サブユニットとtatシグナルによりフォールディング後に輸送され、電子伝達サブユニットがsecシグナルで別に輸送されたのちにヘテロトリマーを形成することとは対照的である。このヘムcドメイン融合AcPQQGDHは、電子移動ドメインを融合することにより電極との直接電子移動を達成した初めての酵素である。

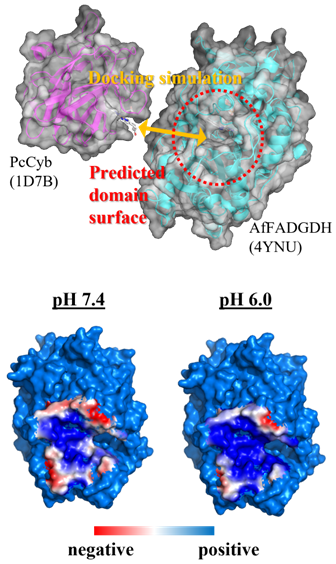
真菌由来のFADGDHは、自己血糖計測用のセンサ用酵素として現在最も普及している酵素であるが、電極との直接電子移動能は有しない。我々はAspergillus flavus由来 FADGDH (Af FADGDH) のX線結晶構造をFADGDHとして世界で初めて報告しているが16)、この構造を基に直接電子移動能を付与することとした。Phanerochaete chrisosporium由来セロビオース脱水素酵素は(PcCDH)、FAD含む触媒ドメインとヘムbドメインがフレキシブルなリンカーで結合した構造を有する。PcCDHはopen/closeのコンフォメーション変化を示し、触媒サブユニットのFADから電子伝達ドメインのヘムbへの分子内電子移動を示す。Af FADGDHのN末端側に、このPcCDHの電子伝達ドメインをリンカーを含めて融合し (Pcyb-Af GDH)、直接電子移動型FADGDHの構築を試みた17)。Pcyb-Af GDHの酵母を用いた組換え発現の結果、目的の融合酵素は活性、ヘムbともに有する状態で分泌発現されることが確認された。また、Pcyb-Af GDHは電極上での直接電子移動を示した。Pcyb-Af GDHの分子内電子移動効率のpH依存性の検討の結果、高pHに比べて低pHでの分子内電子移動効率の改善が観察された。そこで、Pcyb-Af GDHの分子内電子移動効率を改良することを目的として、Pcyb-Af GDHの触媒ドメインに対する変異を導入することとした18)。Pcyb-Af GDHの触媒ドメインと電子伝達ドメインのドメイン界面をドッキングシミュレーションにより予測した後、予測されたドメイン界面の表面電荷のpH依存性を検討した結果、高pHにおいては、ドメイン界面中心部は正電荷、ドメイン界面辺縁に負電荷が分布しており、この電荷分布によるドメイン間の静電的反発が起こることが予測された (図3)。この検討結果を受けて、融合タンパク質のドメイン界面の静電的反発を考慮して、変異を導入した酵素を構築した。その結果、いずれの変異酵素も分子内電子移動が改善し、これに伴い直接電子移動能も向上した。この検討から、複数の酸化還元中心を介する直接電子移動型酵素の構築に関して、電極との電子授受のみでなく、分子内電子移動の改善の重要性が示された。

大腸菌由来Cyt b562をBotryotinia fuckeliana由来FADGDH (Bf GDH) に融合した検討は、直接電子移動を示す酵素中のドメインではなく、天然に存在するシトクロムを融合することで直接電子移動能を付与した例として挙げられる19)。Cyt b562の融合には、フレキシブルなリンカーとして、Pcybのリンカー、もしくはCtEDHのリンカーを用い、融合はN末端側、C末端側、いずれも検討した。その結果、いずれのCyt b562融合Bf GDHも大腸菌の細胞質内でホロ酵素 (FADとヘム、両方を含む) として発現し、直接電子移動能を示した。天然のCyt b562は大腸菌内においてsecシグナルによってぺリプラスムに分泌されるタンパク質であるが、Cyt b562融合Bf GDHにおいて、シグナルペプチドのない状態で細胞質内に発現したことから、b型ヘムは細胞質内のヘムとの結合を示す場合があることが示された。
ヘムを有する電子伝達ドメインを付加することで直接電子移動能を付与するというアプローチにより、非直接電子移動型の酵素に対して直接電子移動能を付与した上に、酵素のその他の機能改変を組み合わせた例として、Aerococcus viridans由来乳酸脱水素酵素 (AvLOx) に対するヘムドメイン融合を紹介する20)。AvLOxはフラビンモノヌクレオチド (FMN) を補酵素とし、乳酸からピルビン酸への反応を触媒する酸化酵素である。その基質特異性と安定性から、第2世代型乳酸センサのセンサ素子として用いられている。AvLOxは酸化酵素であり、酸素を電子受容体とする。そのため、電極との電子授受に際して、酸素が競合する。そこで、AvLOx中の酸素の経路を遮断して脱水素酵素化する変異、A96Lを導入した。このAvLOx変異体に対して、Pichia pastoris由来フラボシトクロムb2 (PpFcb2) のシトクロムドメインを融合した (b2LOx)。b2LOxは酵素活性を有し、ヘムbを結合した状態で大腸菌での組換え発現が可能あった。また、b2LOxの分子内電子移動は吸収スペクトルにて確認され、b2LOx固定化電極による直接電子移動も確認された。さらに、LOxは汗中の乳酸濃度の測定範囲に適しさないこと、および基質阻害を示すことから、b2LOxにおいて基質の乖離に関与する残基 (Ala95) に対して変異導入を行った。得られた変異体は高い触媒活性を維持しながら基質阻害が軽減され、かつ高濃度の乳酸測定も可能であった。この変異の導入により、b2LOx固定電極における乳酸の測定範囲は広がり、実用性を増した。このように構築された直接電子移動型改変乳酸酸化酵素をBcFADGDHと組み合わせ、同一のセンサチップ上の電極に対して異なる酵素をドロップキャストを基本とした方法で乳酸センサとグルコースセンサのマルチプレックスセンサを構築し、同時測定を達成している。このようなマルチプレックスセンサを簡便な方法で作製できるのは、複数の直接電子移動型酵素を用いることによってのみ達成できることであり、直接電子移動型の酵素を創出する大きいモチベーションとなる。
3-3 メディエータの化学的修飾による疑似直接電子移動能の付与
3-2項では非直接電子移動型酵素に対して電子伝達ドメインを付与することで直接電子移動型酵素を創出できることを示した。これに対して、化学修飾により、酵素に対して、電極への電子移動能を簡便に付与する方法として、電子メディエータを化学的に修飾する例21)を紹介する。
電子受容体の化学的修飾という方法は、フェロセンとその誘導体を修飾するといった検討が1980年代から行われている。しかし、その大半は煩雑な修飾方法をとるものであった。最近、スクシンイミド基やマレイミド基を有するメディエータ誘導体が市販されるようになり、これらを用いて、タンパク質上のアミノ基 (リジン残基) やチオール基(システイン残基)を介して簡便に酵素上にメディエータを修飾できるようになった。
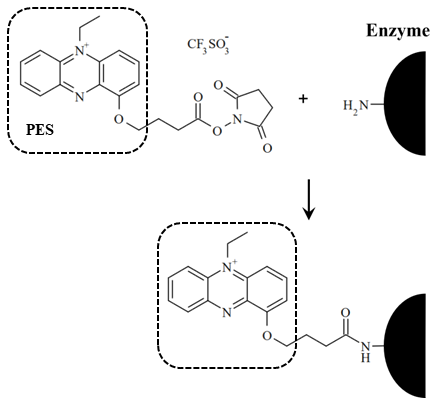
N-hydroxysuccinimidyl ester 1-propoxy-5-ethylphenazinium ethyl sulfate (amine-reactive PES = arPES) はスクシンイミド基と電子メディエータであるフェナジンエトサルフェートが結合したアミノ基反応性電子メディエータである。この分子は、スクシンイミド基と1級アミンとの反応により、電子受容体であるPESを酵素上のリジン残基およびN末端に対して修飾できるような構造となっている (図4)。Bf FADGDH、Rhizobium radiobacter由来グルコース3脱水素酵素 (G3DH) およびAvLOxに対して、arPESを用いたPESの修飾を行った。PESの修飾反応は高pHの緩衝液中にて短時間で行い、カーボンインクをベースとした電極上に固定して、基質に対する応答を検討した。いずれの酵素に関してもPES修飾による酵素の活性の低下は観察されず、また、PES修飾酵素は外部電子受容体の非存在下において電極に対する電子移動を示した。この結果から、本方法により2.5世代型酵素センサといえる疑似直接電子移動を示す酵素を簡便に調製できることが示された。この方法は、酵素表面上のリジン残基への電子メディエータの修飾を行なっているため、疑似直接電子移動が観察されない場合、あるいはその能力が低い場合には、酵素上の適切な位置にリジン残基をデザインすることで、PESと酵素の活性中心との電子授受を最適化することができる22-24)。

4.おわりに
本稿では、直接電子移動を示す酵素の電子伝達サブユニットへの改変による酸化還元電位の改変、および、非直接電子移動型酵素に対する直接電子移動能の付与に関して、著者の関係する成果を中心に紹介した。今後、直接電子移動型酵素の電子移動能のさらなる改変や、電極への固定化方法の検討などにより、直接電子移動型酵素を用いた電気化学的酵素センサの実用化が進むことが期待される。
謝辞
本稿の執筆にあたり、多大なご助言をいただいた、ノースカロライナ大学チャペルヒル校の早出広司教授に、深く感謝を申し上げます。
文献
1) Yamashita, Y., Lee, I., Loew, N., Sode, K.: Curr. Opin. Electrochem., 12, 92 (2018).
2) Sode, K., Tsugawa, W., Yamazaki, T., Watanabe, M., Ogasawara, N., Tanaka, M.: Enz. Microb. Technol., 19, 82 (1996).
3) Yamazaki, T., Tsugawa, W., Sode, K.: Appl. Biochem. Biotechnol., 77-79, 325 (1999).
4) Inose, K., Fujikawa, M., Yamazaki, T., Kojima, K., Sode, K.: Biochim. Biophys. Acta, 1645, 133 (2003).
5) Tsuya, T., Ferri, S., Fujikawa, M., Yamaoka, H., Sode, K.: J. Biotechnol., 123, 127 (2006).
6) Okuda, J., Yamazaki, T., Fukasawa, M., Kakehi, N., Sode, K.: Anal. Lett., 40, 431 (2007).
7) Lee, I., Loew, N., Tsugawa, W., Lin, C., Probst, D., La Belle, J., Sode, K.: Bioelectrochemistry, 121, 1 (2018).
8) Lee, I., Loew, N., Tsugawa, W., Ikebukuro, K., Sode, K.: Biosens. Bioelectron., 124–125, 216 (2019).
9) Shiota, M., Yamazaki, T., Yoshimatsu, K., Kojima, K., Tsugawa, W., Ferri, S., Sode, K.: Bioelectrochemistry., 112, 178 (2016).
10) Yamashita, Y., Suzuki, N., Hirose, N., Kojima, K., Tsugawa, W., Sode, K.: Int. J. Mol. Sci., 19, 931 (2018).
11) Okuda-Shimazaki, J., Loew, N., Hirose, N., Kojima, K., Mori, K., Tsugawa, W., Sode, K.: Electrochim. Acta, 277, 276 (2018).
12) Kaida, Y., Hibino, Y., Kitazumi, Y., Shirai, O., Kano, K.: Electrochem. Commun., 98, 101 (2019).
13) Okuda, J., Wakai, J., Sode, K.: Anal. Lett., 35, 1465 (2002).
14) Okuda, J., Wakai, J., Yuhashi, N., Sode, K.: Biosens. Bioelectron., 18, 699 (2003).
15) Okuda, J., Sode, K.: Biochem. Biophys. Res. Commun., 314, 793 (2004).
16) Yoshida, H., Sakai, G., Mori, K., Kojima, K., Kamitori, S., Sode, K.: Sci Rep., 5, 13498 (2015).
17) Ito, K., Okuda-Shimazaki, J., Mori, K., Kojima, K., Tsugawa, W., Ikebukuro, K., Lin, C. E., La Belle, J., Yoshida, H., Sode, K.: Biosens. Bioelectron., 123, 114 (2019).
18) Ito, K., Okuda-Shimazaki, J., Mori, K., Kojima, K., Tsugawa, W., Asano, R., Ikebukuro, K., Sode, K.: Biosens. Bioelectron., 176, 112911 (2021).
19) Yanase, T., Okuda-Shimazaki, J., Mori, K., Kojima, K., Tsugawa, W., Sode, K.: Biochem. Biophys. Res. Commun., 530, 82 (2020).
20) Hiraka, K., Tsugawa, W., Asano, R., Yokus, M. A., Ikebukuro, K., Daniele, M. A., Sode, K.: Biosens. Bioelectron., 176, 112933 (2021).
21) Hatada, M., Loew, N., Inose-Takahashi, Y., Okuda-Shimazaki, J., Tsugawa, W., Mulchandani, A., Sode, K.: Bioelectrochemistry, 121, 185 (2018).
22) Hiraka, K., Kojima, K., Tsugawa, W., Asano, R., Ikebukuro, K., Sode, K.: Biosens. Bioelectron., 151, 111974 (2020).
23) Suzuki, N., Lee, J., Loew, N., Takahashi-Inose, Y., Okuda-Shimazaki, J., Kojima, K., Mori, K., Tsugawa, W., Sode, K.: Int. J. Mol. Sci., 21, 1137 (2020).
24) Hatada, M., Saito, S., Yonehara, S., Tsugawa, W., Asano, R., Ikebukuro, K., Sode, K.: Biosens. Bioelectron., 177, 112984 (2021).