【トピックス】
酸素感受性ニトロゲナーゼを好気条件下の細胞内で機能させるための因子とその応用
黒田浩一、滝本 廉、植田充美
京大院・農
1.はじめに
窒素はリン、カリウムとともに植物の成長に欠かせない元素であり、アンモニアは植物の肥料として、人口増加に伴う食物増産に重要な物質である。また、窒素化合物の多くはアンモニアを出発物質としており、化成品原料として私たちの生活を支えている。さらに、アンモニアは燃焼時に二酸化炭素を放出しない、水素含量が高いため分解することで水素発生源となる、液体での輸送が可能である、といった特徴を有する。そのため、近年ではカーボンフリー燃料や水素キャリアーとして注目を集め、地球環境保全に向けて今後のさらなる需要の増加が見込まれている1)。
アンモニアの工業的生産のほとんどが、水素と窒素を触媒存在下で直接反応させるハーバー・ボッシュ法によって行われている。しかし、350~550℃、150~350 atmといった高温・高圧条件を必要とするため、アンモニア生産の過程で莫大なエネルギー消費と大量の二酸化炭素の放出を伴い、環境への負荷が大きいという負の側面を有する。世界で消費されるエネルギーの数%がアンモニア生産に使われ2)、人為的に放出される二酸化炭素の1.2%がアンモニア生産に起因している3)。したがって、2017年に国連が提唱した持続可能な開発目標 (SDGs) にて環境負荷低減への取り組みが加速する中、ハーバー・ボッシュ法に代わる温和な条件下でのアンモニア生産法を確立することが、地球規模の課題として認識されつつある。
筆者らは、常温・常圧にてアンモニア生産が可能な生物学的窒素固定に着目し、そこで重要な役割を果たすニトロゲナーゼの有効利用を可能にする新たな因子を発見してきた。本稿では、好気条件下にてニトロゲナーゼの活性維持に関わる因子の発見とその応用について紹介する。
2.窒素固定酵素ニトロゲナーゼの特徴
自然界では、大気中に78%含まれる不活性な窒素分子をアンモニアとして固定する微生物 (窒素固定菌) が存在する。人類はこのような生物学的窒素固定を利用してきたが、食物増産のための化学肥料や工業製品に必要な量が増大し、その量をカバーするため、上述のハーバー・ボッシュ法による工業的固定が行われるようになった。窒素固定菌によって生産されるニトロゲナーゼは、生物学的窒素固定において中心的な役割を果たす酵素である。本酵素はATPをエネルギー源として常温・常圧で大気中の窒素分子をアンモニアに変換することができるため、アンモニア生産時に化石燃料を必要とせず二酸化炭素も放出しないといった特長をもつ4)。したがって、地球環境保全の観点で非常に優れており、ニトロゲナーゼの有効利用が可能になれば、持続可能な社会の実現に向けて大きな前進が期待される。しかし、ATP量を増やすため好気条件にしたい反面、ニトロゲナーゼは酸素に非常に弱く、大気中の酸素に触れると数分間で不可逆的に失活するというジレンマを抱えているため5)、その有効利用は進展していないのが実情である。また、窒素固定能の付与に向け、ニトロゲナーゼ関連遺伝子の異種発現を試みた例も報告されているが、嫌気条件下での活性に限定されている6)。
3.好気性窒素固定細菌Azotobacter vinelandii
一方、このような酸素感受性にもかかわらず、自然界には好気条件下においてもニトロゲナーゼの活性を維持して窒素固定を行う微生物 (好気性窒素固定細菌) が存在する。中でもAzotobacter vinelandiiは、生育に酸素を必要としながら、酸素に感受性のニトロゲナーゼを用いて大気中の窒素を固定することができる7)。このような相反する2つの事象を両立させるというユニークな性質をもつことから、本菌は進化の過程で独自の機構 (好気条件下でもニトロゲナーゼ活性を維持する機構、以下、活性維持機構と呼ぶ) を獲得してきたと考えられる。したがって、A. vinelandiiがもつ活性維持機構を明らかにすることができれば、好気条件下でのニトロゲナーゼの有効利用が期待でき、生物学的窒素固定を用いたアンモニア生産法の確立につながる可能性がある。
ニトロゲナーゼを酸素から保護する機構に関しては、代表的な窒素固定細菌である根粒菌で研究が進められてきた。根粒菌はマメ科植物と共生し、根粒を形成する。その根粒内では、酸素と親和性の高いヘモグロビン様の物質 (レグヘモグロビン) が作られ、根粒内の酸素濃度を低く保つことでニトロゲナーゼ活性を維持すると考えられている8)。しかし、このような根粒形成は共生菌独自の性質であり、広く応用展開するには大きな困難が伴う。これに対し、A. vinelandiiは他の生物とは共生しない自由生活細菌であるため、自らの細胞内でニトロゲナーゼを酸素から保護する必要があり、その機構に関する知見は応用するうえで非常に有用である。これまでのA. vinelandii の研究において、ニトロゲナーゼ活性を維持する3つの機構が示唆されてきた。①アルギン酸ポリマーで細胞表面が覆われ、細胞内への酸素の透過を物理的に阻害する9)、②好気呼吸に関与する酵素 (シトクロム) を細胞膜上に大量発現し、呼吸により速やかに酸素を水に変換する10)、③ニトロゲナーゼの活性部位に結合するFeSIIタンパク質を発現し、酸素に弱い部分を保護する11)。しかし、これらの機構がニトロゲナーゼの活性維持において決定的な役割を果たすものであるかについては議論の余地がある。
4. 網羅的な遺伝子発現解析によるニトロゲナーゼ活性維持関連因子の探索
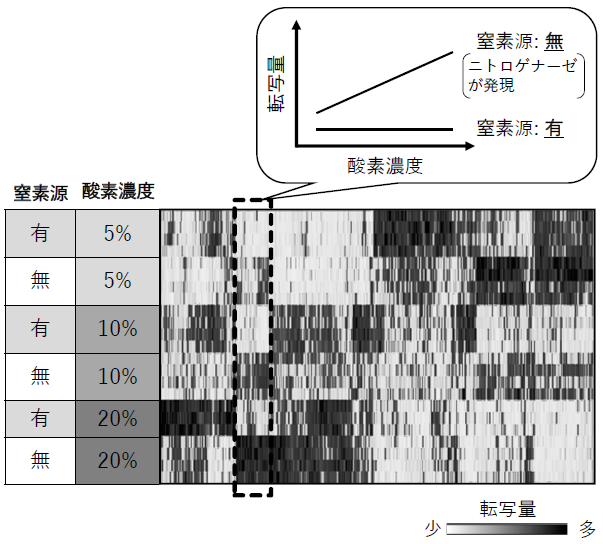
これまでの研究にて示唆された上記3つの機構に基づいて、好気条件下でのニトロゲナーゼ活性を向上させた例は報告されていない。このことから、筆者らは上記3つの機構では活性維持への寄与は小さく、さらに重要な未知因子が存在するのではないかと考え、その探索を試みた。過去の知見や手掛かりに乏しい因子を明らかにするうえで、細胞の全遺伝子の転写量やタンパク質量などを網羅的に定量解析する戦略が有効である。筆者らは、生体分子の網羅的定量解析により様々な生命現象を俯瞰的にとらえることで、仮説ベースでは到達できない新たな知見を得てきた12)。そこで、活性維持に重要な遺伝子を同定するため、細胞内の全遺伝子の転写量を定量解析するトランスクリプトーム解析を行った13)。好気条件下でのニトロゲナーゼ活性の維持に関わる遺伝子は、①ニトロゲナーゼが生産される条件 (アンモニアなどの窒素源を含まない培地) においてのみ転写が誘導され、かつ、②酸素濃度依存的に転写が誘導される、といった2つの特徴的な転写パターンを示すと考え、条件設定を行った。
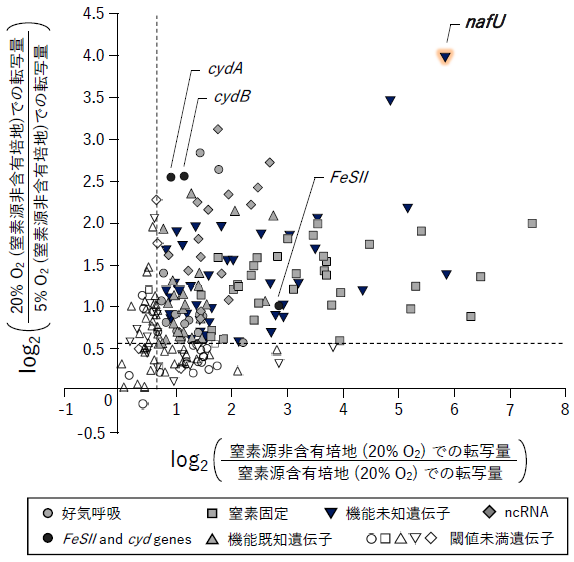
窒素源について2条件 (窒素源含有、非含有)、酸素濃度について3条件 (5%、10%、20%) の組み合わせで計6条件を設定してA. vinelandiiを培養した後、RNAを抽出し、RNA-seq解析により各サンプル間で全遺伝子の転写レベルを比較定量した。その結果、上記2つの転写パターンを示す213個の遺伝子を活性維持機構に関わる候補として同定することができた (図1)。さらに、転写変動量と推定機能に基づき、同定した213個の中で活性維持機構への寄与が大きいと考えられるものを絞り込んだ。具体的には、①ニトロゲナーゼ生産が誘導される窒素源非含有培地において、酸素濃度20%の時の転写量が酸素濃度5%の時の転写量の1.5倍以上、②酸素濃度20%において窒素源非含有培地での転写量が窒素源含有培地での転写量の1.5倍以上、という基準を設け、両基準を満たす遺伝子を選別した (図2)。ここで絞り込まれた遺伝子群には、好気呼吸関連遺伝子、窒素固定関連遺伝子、以前の研究にて活性維持機構との関連が示唆されたFeSII、cydA、cydBなどの遺伝子が含まれていた。筆者らは、これまで活性維持に決定的な役割を果たす因子が見つかっていないことから、機能未知遺伝子の中に重要なものが含まれていても不思議ではないと考えた。実際に、今回の絞り込みで多くの機能未知遺伝子が同定されたことは興味深い点であった。中でも機能未知遺伝子nafUは上記の絞り込み基準①②ともに大きな転写変動量を示したため (好気条件と窒素固定条件の両方で強く転写誘導)、候補遺伝子として着目し、さらに解析を進めた。


5.nafU遺伝子の活性維持機構への寄与
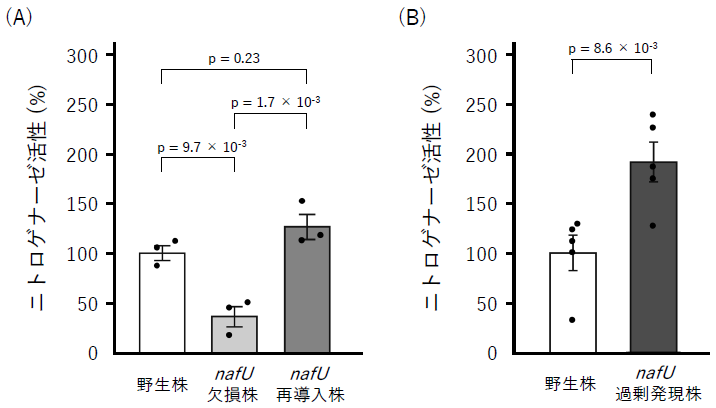
機能未知遺伝子nafUが活性維持機構に寄与するかどうかを明らかにするため、A. vinelandiiにおいてnafUの遺伝子破壊および過剰発現を行い、好気条件下におけるニトロゲナーゼ活性への影響を調べた13)。nafU欠損株は、相同組換えによりゲノムDNA上のnafU遺伝子を抗生物質 (クロラムフェニコール) 耐性遺伝子に置き換えることで作製した。また、nafU欠損株の抗生物質耐性遺伝子を再びnafU遺伝子配列に置き換えて欠損を元に戻したnafU再導入株も作製した。さらに、nafU過剰発現株は、相同組換えによりnafUプロモーターを高発現型のnifHプロモーターに置き換えることで作製した。これらの3株と野生株のA. vinelandiiを用い、好気条件下におけるニトロゲナーゼ活性を測定した。その結果、nafU欠損株では野生株に比べて活性が約3分の1に低下し、nafU遺伝子の再導入によって野生株と同程度の活性を示した (図3A)。また、nafU遺伝子の過剰発現により活性が約2倍に向上した (図3B)。したがって、筆者らが見出したnafU遺伝子は活性維持機構において重要な役割を果たす因子であることが示唆された。

6.nafU遺伝子のニトロゲナーゼ異種発現系への応用
以上のように、好気条件下でのニトロゲナーゼ活性維持機構におけるnafU遺伝子の重要性が示唆されたため、他の微生物への応用可能性を検証した13)。A. vinelandiiは好気性窒素固定細菌としてニトゲナーゼ研究によく用いられるが、倍加時間が長く (2時間)、培養時に大量の多糖類を細胞外に放出することから、応用利用にはあまり適していない。この点に関しては、やはり大腸菌などのモデル微生物に一日の長があり、倍加時間や生育条件で非常に有利であるため、このような微生物においてニトロゲナーゼを異種発現し、好気条件下でも機能できるようになれば、生物学的窒素固定を実利用していくうえで大きなメリットとなる。筆者らは、まずニトロゲナーゼを発現する大腸菌を構築し、次にnafU遺伝子を追加で発現させることにより、好気条件下で大腸菌内に発現させたニトロゲナーゼの活性にどのような影響を与えるのかを調べた。
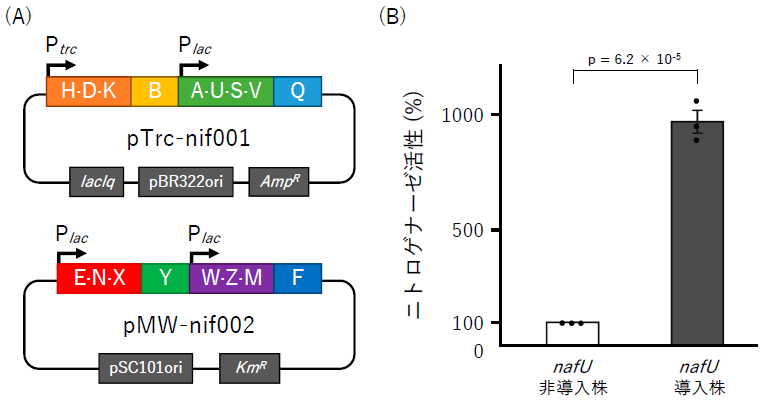
大腸菌にてニトロゲナーゼを機能的に発現させる際、A. vinelandiiの先行研究の結果14)をもとに17個の関連遺伝子が必要であると考えられた。そこで筆者らはこれら17個の遺伝子をA. vinelandiiのゲノムDNAから取得した後、人工遺伝子クラスターを設計して2種類の大腸菌発現用プラスミドに挿入し、大腸菌にて発現させた (図4A)。さらに、大腸菌発現用にコドンを最適化したnafU遺伝子の発現プラスミドを構築し、ニトロゲナーゼ発現大腸菌に導入した (nafU導入株)15)。また、コントロールとして、nafU遺伝子配列を持たない空プラスミドを導入したnafU非導入株を用意した。これらの大腸菌株の好気条件下におけるニトロゲナーゼ活性を測定したところ、nafU導入株ではnafU非導入株と比較して活性が約9.7倍に上昇した (図4B)。したがって、筆者らが見出したnafU遺伝子は、大腸菌においても機能的であり、A. vinelandiiの時と同様に好気条件下でのニトロゲナーゼ活性の維持に重要な役割を果たすことが分かった。

7.nafUタンパク質の機能推定
遺伝子名は付けられているものの、nafU遺伝子にコードされるnafUタンパク質の機能についてはこれまで不明のままであった。筆者らはnafUタンパク質の構造、局在、他の遺伝子発現に与える影響といった幾つかの側面から解析を行い、その機能推定を試みた13)。まず、2次構造がnafUタンパク質と類似しているものをJPred416)によって検索したところ、放線菌が作るslyBタンパク質が見つかった。slyBタンパク質は細胞膜上に局在し、膜の安定性を高めることで細胞内をストレス因子から保護することが知られている17)。そこで、筆者らはnafUタンパク質がslyBタンパク質と同様の機構で、細胞内に生産したニトロゲナーゼを酸素から保護しているのではないかと考えた。この仮説を検証するため、nafUタンパク質の局在を調べるとともに、nafUタンパク質が細胞内の酸素濃度に与える影響について、全遺伝子の転写量変化をもとに間接的な評価を行った。
C末端にHisタグを付加したnafUタンパク質を作らせるため、タグ配列をゲノムDNAに挿入したA. vinelandii株を構築した。次に窒素源非含有培地にて好気的に培養した後、細胞分画を行った。分画によって得た各画分 (細胞内、細胞膜、細胞外膜) についてウエスタンブロッティングにより解析したところ、nafUタンパク質が細胞膜上に局在していることが分かった。また、細胞内の酸素濃度に与える影響を調べるため、A. vinelandiiの野生株とnafU欠損株について比較トランスクリプトーム解析を行い、どのような遺伝子の発現に影響を及ぼすのかを調べた。その結果、nafU欠損株では酸素濃度依存的に発現が誘導される遺伝子の発現量が上昇していることを見出し、nafUタンパク質は細胞膜に作用して細胞内の酸素濃度を減少させる機能を持つことが推定された。しがたって、nafUタンパク質はこれまでに示唆された3つの活性維持機構とは異なる作用で、好気条件下のニトロゲナーゼ活性維持に寄与していると考えられる。
8.おわりに
好気性窒素固定細菌A. vinelandiiは好気的に生育しながら、酸素により不可逆的に失活するニトロゲナーゼを機能させるという、相反する2つの事象を両立させることができ、進化の過程で基礎的にも応用的にも興味深い独自の機構を獲得してきた。ニトロゲナーゼの有効利用に向け、このような有用機能を分子レベルで明らかにすることが重要であるが、これまでその機構を十分に説明できていない状況であった。筆者らは、以前の知見にとらわれず、細胞全体の生命活動を遺伝子発現レベルで網羅的に調べ、様々な培養条件を設定して絞り込むことで、機能未知であったnafU遺伝子が重要な因子であることを見出した。nafU遺伝子は好気条件下でのニトロゲナーゼの活性維持に必要な因子であり、A. vinelandiiだけでなくニトロゲナーゼを発現させた大腸菌においても同様の機能を示した。これは、好気条件下でのニトロゲナーゼ活性を大きく向上させた初めての例である。さらにnafUタンパク質は細胞膜に局在し、細胞内の酸素濃度を抑えることで活性維持に寄与していると考えられ、これまで示唆された活性維持機構とは異なるものであった。今後、これらの知見をもとに、これまで不明であった好気条件下でのニトロゲナーゼ活性維持の完全解明につながることが期待される。
また、大腸菌のような異種微生物に応用できたことは意義深く、異種発現したニトロゲナーゼを好気条件下にて機能させ、生物学的窒素固定の工業的利用を進展させるうえで非常に有用である。自然界にはニトロゲナーゼのように有用な機能をもちながらも、酸素に非常に弱いことが原因でその有効利用や研究が十分進んでいない酵素が存在する。今回の知見により、ニトロゲナーゼ以外の様々な酸素感受性酵素の好気的利用に発展することも期待できる。
文献
1) Valera-Medina, A., Amer-Hatem, F., Azad, A. K., Dedoussi, I. C., de Joannon, M., Fernandes, R. X., Glarborg, P., Hashemi, H., He, X., Mashruk, S., McGowan, J., Mounaim-Rouselle, C., Ortiz-Prado, A., Ortiz-Valera, A., Rossetti, I., Shu, B., Yehia, M., Xiao, H., Costa, M.: Energy & Fuels, 35, 6964 (2021).
2) Pfromn, P. H.: J. Rnew. Sustain. Energy, 9, 034702 (2017).
3) Norskov, J., Chen, J.: Sustainable Ammonia Synthesis, US DoE Round Table Report (2016).
4) Gtari, M., Ghodhbane-Gtari, F., Nouioui, I., Beauchemin, N., Tisa, L. S.: Arch. Microbiol., 194, 3 (2012).
5) Eady, R. R., Smith, B. E., Cook, K. A., Postgate, J. R.: Biochem. J., 128, 655 (1972).
6) Yang, J., Xie, X., Xiang, N., Tian, Z. X., Dixon, R., Wang, Y. P.: Proc. Natl. Acad. Sci. USA, 115, E8509 (2018).
7) Noar, J. D., Bruno-Barcena, J. M.: Microbiol., 164, 421 (2018).
8) Ott, T., van Dongen, J. T., Gunther, C., Krusell, L., Desbrosses, G., Vigeolas, H., Bock, V., Czechowski, T., Geigenberger, P., Udvardi, M. K.: Curr. Biol., 15, 531 (2005).
9) Sabra, W., Zeng, A. P., Lunsdorf, H., Deckwer, W. D.: Appl. Environ. Microbiol., 66, 4037 (2000).
10) Ackrell, B. A., Jones, C. W.: Eur. J. Biochem., 20, 29 (1971).
11) Maier, R. J., Moshiri, F.: J. Bacteriol., 182, 3854 (2000).
12) Kuroda, K., Hammer, S. K., Watanabe, Y., Montaño López, J., Fink, G. R., Stephanopoulos, G., Ueda, M., Avalos, J. L.: Cell Systems, 9, 534 (2019).
13) Takimoto, R., Tatemichi, Y., Aoki, W., Kosaka, Y., Minakuchi, H., Ueda, M., Kuroda, K.: Sci. Rep., 12, 4182 (2022).
14) Hamilton, T. L., Ludwig, M., Dixon, R., Boyd, E. S., Dos Santos, P. C., Setubal, J. C., Bryant, D. A., Dean, D. R., Peters, J. W.: J. Bacteriol., 193, 4477 (2011).
15) Tatemichi, Y., Nakahara, T., Ueda, M., Kuroda, K.: Biosci. Biotech. Bioch., 85, 2209 (2021).
16) Drozdetskiy, A., Cole, C., Procter, J., Barton, G. J.: Nucleic Acids Res., 43, W389 (2015).
17) Plesa, M., Hernalsteens, J. P., Vandenbussche, G., Ruysschaert, J. M., Cornelis, P.: Res. Microbiol., 157, 582 (2006).