【トピックス】
唾液を用いたがん検査の現状と課題
杉本昌弘
東京医・医総研、慶應大・先端生命
1.はじめに
がんの早期発見には、血液などの体液中からがん患者に特異的にみられるバイオマーカー物質を高感度に検出する技術が必要である。著者らは唾液中の代謝物でがん患者に特異的に、濃度が変化する物質について質量分析装置を用いて検出し、その精度を検証する臨床研究を実施してきた。唾液は痛みがなく採取することができることや尿に比べて採取場所も限定されないことなど、様々なメリットがある。一方、採取方法や保存方法を統一しなければバイオマーカーの値が変動してしまう問題がある。検体全体として濃度の差異も発生し、更に唾液の場合では痰が含まれることにより粘液性や白濁度合いが高くなることなどもあるため、これらの様々な影響を最小化する技術開発も必要となる。ここでは、がんのマーカーを事例として唾液検査開発の現状と課題に関して紹介する。
2.唾液検査の必要性
様々な疾患の早期発見のためには、体に負担が少ない検査を高頻度で行うことが望まれる。特にがんは早期発見が重要であることはだれもが認識しているものの、初期の段階では無症状であるなどの理由で、定期的な検診以外で自ら主体的に検査を行うことは少ないと考えられる。一方、発見時には大部分が進行期であるようなすい臓がんなどでは年に1度の検査ではなく、より高頻度な検査をすることが早期発見の可能性を高める一つの方法として挙げられる。しかし、やみくもに定期健診の頻度を上げることは被験者にも負担をかけ、医療経済的にもコストの上昇が懸念される。血液中の腫瘍マーカーであるCA19-9やCEAは早期には上昇してこないために、これらを早期発見の目的で利用することに高い価値が得られないと言われている。そこで、高頻度の検査を実現しつつも高感度にがんを検出する技術の開発が必要となる。唾液などの侵襲性 (体への痛み等の負担) が少ない体液に含まれるがんに特異的で新たなバイオマーカーを同定し、がんを識別する指標を作ることができれば、これらの問題を解決できる可能性があると考えられる1)。
3.バイオマーカーの探索
がんを体液中の情報で検査しようとする技術はリキッドバイオプシーと呼ばれ、検出対象となる分子はバイオマーカーと呼ばれる。血中を流れるcirculating tumor DNA (ctDNA)やcell-free DNA (cfDNA)からがん患者を識別しようとする試みは世界的に行われており、DNAのメチル化、腫瘍マーカーのようなタンパク質、がん細
胞から特異的に分泌されるエクソソーム等様々な物質やその修飾状態が、がんを識別する指標として同定されてきた。著者らは代謝物を対象としてがん患者の検体に特異的にみられる変化を探索してきた。
3-1 メタボローム解析
メタボローム解析とは、代謝物 (メタボライト) を網羅的に測定する技術 (オミックス) の造語で、代謝物を網羅的に測定する方法である。ヒトの生体内にはおおよそ3000種類の代謝物があると言われており、アミノ酸、核酸、脂質など様々な分子が含まれる。これらの分子は化学的な特徴が大きく異なるために単一の測定方法で全ての代謝物を測定することは現在でも実現できていない。このために異なる複数の測定方法を組み合わせて測定可能な物質種を広げることが行われてきた。
広く利用される検出器では核磁気共鳴 (Nuclear Magnetic Resonance; NMR) と質量分析装置 (Mass spectrometry; MS) がある。NMRは測定試料を非破壊的に測定できる大きなメリットがある2)。ただし、感度は低く生体内に高濃度で含有される物質しか測定できない。一方MSは感度が高く生体内に低濃度でしか含有されない物質も検出することができる。しかし、例えば細胞内の代謝物を測定する場合は、細胞膜を破壊してその中の代謝物を抽出するなどの測定試料に破壊的な処理をする必要がある。
MSは異なる質量の代謝物を個別に測定することはできるが、同一質量の代謝物を個別に分けて測定することはできない。このために代謝物の化学的な特徴の違いを利用して測定試料中の代謝物を分離し、MSで個別に分けて測定する方法が一般に用いられる3)。分離装置としてはガスクロマトグラフィー(gass chromatography; GC)、液体クロマトグラフィー(Liquid chromatography; LC)、キャピラリー電気泳動(capillary electrophoresis; CE)などがよく利用される (図1)。GCは揮発性物質を分離することができる。揮発しない物質も分子の誘導体化の処理をすることで分離が可能となる4)。LCは溶媒に溶ければ様々な代謝物を幅広く測定することができる。しかし個々の分子ごとに処理方法やLCの測定条件を変えなければならないために、測定可能な物質種を広げるためには異なる方法を組み合わせる必要がある5)。CEはイオン性分子の測定に限定されるが、陽イオンと陰イオンの2回の測定で幅広い分子の測定ができる6)。
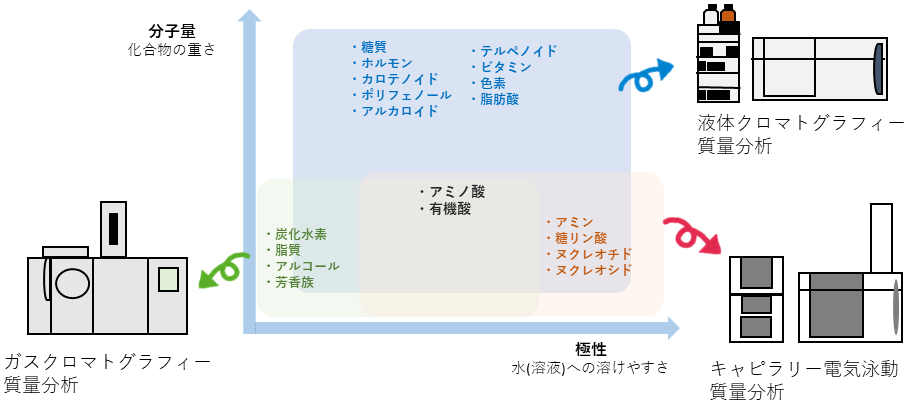
図1 質量分析装置によるメタボローム解析に用いられる分離方法と測定できる分子の関係
3-2 唾液による疾患検査マーカーの研究
唾液による疾患検査のアイデアそのものは古く、コルチゾールのようなストレス性ホルモンの検出や、胚細胞由来の遺伝子変異(germ line mutation)の検査、近年ではCOVID-19の検査等で身近なものとなってきた。欧米では口腔疾患だけでなく、口腔領域から離れたがんなどのスクリーニング検査として、技術開発が積極的に行われてきた。UCLA大学のDavid Wong博士らが中心となってアメリカ歯科医師会にて唾液の採取方法を統一し、様々な疾患のバイオ―マーカー探索を実施してきている7,8)。口腔がんでは、それぞれmRNAをトランスクリプトーム、タンパク質をプロテオーム解析などの技術で一斉測定し、マーカーの候補となる物質を数個まで絞り込んでいる。これらを多重ロジスティック回帰モデルや決定木のような数理モデルを開発し、口腔がん患者を健常者からどの程度の精度で分離できるかを検証している9)。同様の方法をすい臓がんのマーカー探索にも適用している10)。また、唾液による乳がんのマーカー探索の報告も多くされている11)。
3-3 メタボローム解析による唾液のマーカー探索
口腔領域のメタボローム研究としては歯周病疾患のマーカー探索が最も多い。歯肉浸出液も調べられており、歯周病の進行度合いに相関して酸化ストレスの上昇を示唆するようなプリン体代謝の分解促進がみられている12)。同一研究グループによる報告では、唾液中の代謝物において歯周病の進行に合わせてアミノ酸や比較的短いペプチド類の上昇がみられることから、タンパク質の分解が促進されている可能性が示唆された13)。他にも、代謝疾患として糖尿病による変化を調べた例が報告されている14,15)。
がんの中では口腔がんに関する報告が最も多い16-18)。臨床的には口腔がんと白板症や口腔扁平苔癬との識別が重要であるため、比較デザインの中にこれらの疾患を含めた研究例も多い19)。唾液中から揮発性物質を測定して胃がんや大腸がんのマーカーを探索した例などが報告されている20)。これらの研究の中で整合性のある物質や特定の疾患に特異性のある物質等を調べたが、それぞれの研究で測定方法が異なるため、どの疾患でもアミノ酸等に変化がみられるという分析方法に依存する結果となった21)。
3-4 マーカー物質のPathway
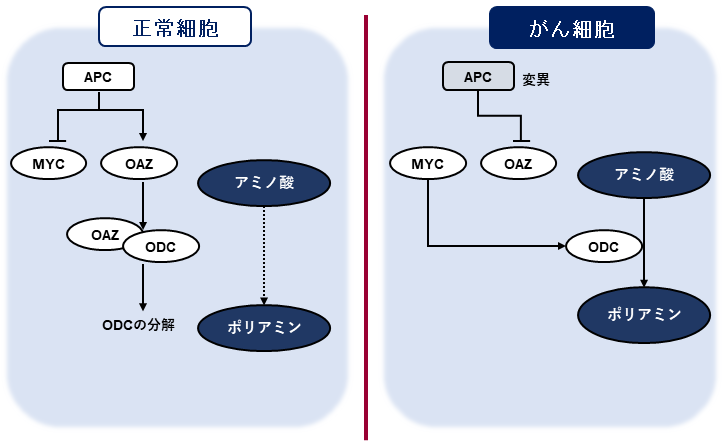
我々は肝臓・胃・大腸などの組織で起きているがんに特異的な代謝異常について調べてきた22)。どの臓器でも同一人物からがん組織と通常組織の両方を採取し、その差分を解析することで個人差の影響を最小化する方法をとった。大腸では様々な進行度のがんだけでなく、前がん病変であるアデノーマも含めて解析した。既にアデノーマの時点で健常な組織と大きく代謝プロファイル (代謝物の濃度パターン) が異なり、この後がん化してその進行度が進んでも、アデノーマにおける変化が最も大きい結果であった。同様に代謝酵素もアデノーマの時点で変化しており、がんの進行度による変化は小さい傾向であった。このため様々ながん促進遺伝子や抑制遺伝子の中でMYCがこれらの代謝の変動を起こす起点となっていると推測し、培養細胞レベルで検証した23)。
唾液はがん患者と健常者から採取し、CE-MSを用いてイオン性物質を網羅的に測定し、これら2群間で違いのある物質を探索した。口腔がんではがん組織検体にて、代謝異常となる物質を探しておき、同一人物から採取した唾液と、健常者から採取した唾液にも同一の変化がみられる物質にマーカーを絞り込む方法をとった24)。
また、様々ながんで共通してポリアミン類がマーカー物質として残る。ポリアミン類は古くからがんのマーカーとして知られ、すい臓がんの組織内の含有量と、尿中のポリアミン濃度が正に相関するということが1990年代に報告されている25)。ポリアミンは、尿素回路のオルニチン脱炭酸酵素(ornithine decarboxylate; ODC)によってプトレシンに変換される。プトレシンはその後スペルミジンやスペルミンに変換される (図2)。更にこれらの物質はスペルミジン/スペルミンN1-アセチルトランスフェラーゼ(SSAT)によってアセチル化される。通常の細胞ではこれらが一定の範囲に保たれているが、がん細胞ではポリアミン類が過剰な状態となりアセチル化により不活性化し、細胞外に排出される。尿においては大腸がんや乳がんにおいてアセチル化が2段階進んだN1, N12-ジアセチルスペルミンが最も感度よく上昇することが知られている。
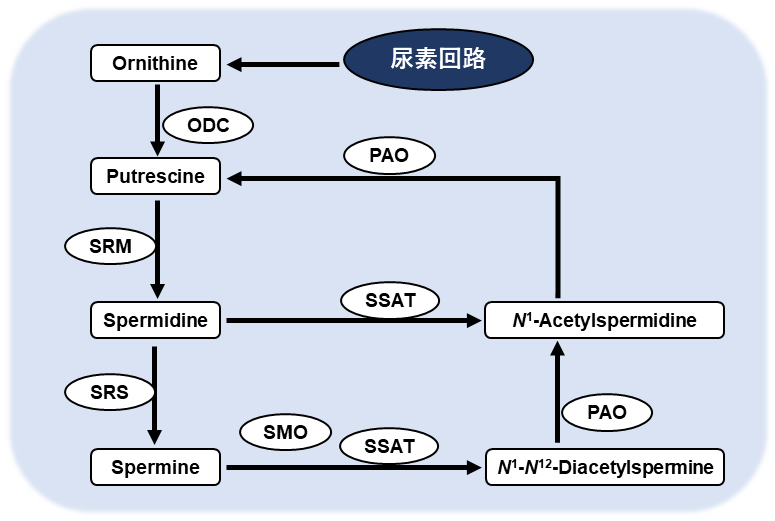

ポリアミン合成の律速酵素はODCである。がん抑制遺伝子APCの下流にMYCが位置し、そのMYC遺伝子の更に下流に位置する (図3) 26)。APC遺伝子の変異によるMYCの活性化はアデノーマの時点でも起こるために、がんだけでなくアデノーマにおいてもこれらの代謝の変化が起きうると考えられる27)。

3-5 唾液中のポリアミン類
唾液中のポリアミン類の上昇は、乳がん患者の検体にて報告されている。再発症例では更に濃度上昇がみられることもあり28)、複数のポリアミンを組み合わせることで進行度に相関した指標を作るなどの報告もされている29)。また、頭頚部がんにおいても唾液中におけるこれらの物質の濃度上昇が知られている。
我々も乳がんや大腸がんにおいてポリアミン類の濃度が上昇することを確認した。しかし、尿と異なりN1, N12-ジアセチルスペルミンが必ずしも感度が最も高い結果ではなかった。むしろアセチル化が1段階、あるいはアセチル化していないポリアミン類の上昇の方が感度がよい結果であり、すい臓がん患者の唾液でも同様の傾向がみられた30)。検出された物質の傾向をみると、アセチル化が進んだ物質は特異性が高いものの感度は低く、アセチル化が進まないものは感度が高いものの特異度は低いというトレードオフの関係になっている。そこで我々はこれらの物質を1つに絞り込むわけではなく、機械学習で複数物質の濃度変化のパターンを学習させ、疾患群を健常者群から識別する指標を開発した。乳がんにおいては、非浸潤性乳管がんではポリアミン類の濃度上昇がみられないが、浸潤性がんでは濃度上昇がみられた31)。また、大腸がんでは2602名の大規模な症例を収集し、半分のデータでモデルの学習をさせ、残り半分のデータで評価を実施した。大腸がんとアデノーマの症例を健常者から識別させる精度として、評価用のデータにおいて受信者動作特性曲線以下の面積が0.870 (95% 信頼区間: 0.837−0.903)となる高い値を示すことをできた32)。
4.現状の課題
唾液のマーカーによるがん検査に関しては、まだ様々な課題がある。例えば検体の採取方法として非刺激性唾液と刺激性唾液があるが、本研究で紹介した研究例は全て前者の採取方法を利用している。非刺激性唾液は主要な3つの唾液腺の中でも耳下腺を通ってでてくる血液由来の成分を大きく反映する。実際に同一人物から非刺激性唾液を採取して、その直後に刺激性唾液を採取して比較したところ、刺激性唾液では全体的に濃度が高い結果が得られた33)。また高齢になるに伴い唾液腺から分泌される水分量が少なくなり、相対的に各物質の濃度が上昇する。尿であればクレアチニン濃度で検体全体の濃淡を補正する方法が確立しているが、唾液の場合統一された方法が確立されていない。このため、独自に唾液の濃い・薄いの影響を補正する物質を用いて、この物質とマーカー物質の組み合わせで識別指標を作ることが現実的な解決策となる。
他にも多数の制限がある。唾液採取前の絶食時間における影響があり、絶食時間が短いほどマーカーの値が低下する傾向がみられた34)。一方、ポリアミン類等はしじみなどの貝類やナッツ類に多く含まれるために、適切な食事制限が必要となる。日内変動も見られるために、採取時間の制限もあると考えられる。しかし、同一被験者から唾液中のプロファイルと唾液分泌量の日内変動と日間変動を調べたところ、懸念しているような大きな変動は見られなかった35)。また、唾液採取前1時間は喫煙や爪楊枝の使用などを禁止しているが、これ以外にも様々な環境要因の影響も見られている36)。口腔内疾患である歯周病やカンジタ症によっても変化するため、がんの非疾患群には様々な条件の症例を含め、がんに特異性の高い指標を開発しなければならない。
また、MSを使った測定を行う限り、唾液の保存・輸送・前処理等と、MSの感度を一定に保つ品質制御も重要となる37)。医療機関以外において個人で唾液を採取する場合は、採取後に冷凍するためのディープフリーザ等が利用できないため、一時的な家庭用の冷凍庫の利用等が考えらえる。このような最適な保存状態を保てない場合におけるマーカー値の劣化を考慮し、定量値に影響しうるノイズを算出、仮想的に同等のノイズを入れた場合にどの程度識別能力が低下するかを調べ38)、現実的な唾液採取から検査までのプロトコルの標準化を進めてきた (図4)。
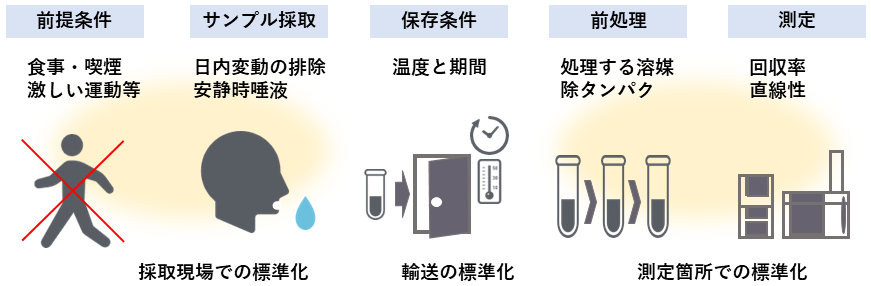
図4 唾液採取前条件から測定までの標準化
口腔領域から離れた臓器で起きるがんに関しては、実際にそのがんの影響が唾液に出てきているのかについてメカニズムを追求することも重要なテーマである。マウスを用いた実験にて、乳がんやすい臓がんから分泌されているエクソソーム様微小胞が、唾液腺の遺伝子発現パターンを変化させて、その結果として唾液中に分泌される分子が異なるという報告がある39,40)。特に口腔がん以外にはこのような分子の移行をトレースした実験が必要である。
5.おわりに
本稿では唾液検査の現状と課題を中心に紹介した。MSを用いたマーカー探索と実用化に向けた採取方法や検体の取り扱い等を紹介したが、より簡便な方法にてマーカー物質を調べる方法に置き換え、低価格かつ高スループットを実現する必要がある。ただし、どれだけ高感度でも単一物質ではがん患者の識別や、検査不適合検体を検知することは難しく、少なくとも1疾患に対して数物質の定量は必要になると考えられる。唾液採取現場ですぐに結果が得られるようなセンサー等に置き換えることができれば、検体輸送の問題等もなくなるため幅広く利用できるスクリーニング検査が現実化できると考えられる。
謝辞
本稿で紹介した研究はJSPS科研費JP20K07633、JP19K08106、JP19K09700、JP19K10304、JP18K07262、JP17K11867、JP17K11897、16H05408の助成を受けたものです。
文献
1) Kaczor-Urbanowicz, K. E., Martin Carreras-Presas, C., Aro, K., Tu, M., Garcia-Godoy, F., Wong, D. T.: Exp. Biol. Med. (Maywood), 242, 459 (2017).
2) Emwas, A. H., Roy, R., McKay, R. T., Tenori, L., Saccenti, E., Gowda, G. A. N., Raftery, D., Alahmari, F., Jaremko, L., Jaremko, M., Wishart, D. S.: Metabolites, 9, (2019).
3) Monton, M. R., Soga, T.: J. Chromatogr. A, 1168, 237 (2007).
4) Shigeyama, H., Wang, T., Ichinose, M., Ansai, T., Lee, S. W.: J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 1104, 49 (2019).
5) Wang, Q., Gao, P., Wang, X., Duan, Y.: Clin. Chim. Acta, 427, 79 (2014).
6) Ramautar, R., Somsen, G. W., de Jong, G. J.: Electrophoresis, 40, 165 (2019).
7) Wang, X., Kaczor-Urbanowicz, K. E., Wong, D. T.: Med. Oncol., 34, 7 (2017).
8) Spielmann, N., Wong, D. T.: Oral Dis., 17, 345 (2011).
9) Li, Y., St John, M. A., Zhou, X., Kim, Y., Sinha, U., Jordan, R. C., Eisele, D., Abemayor, E., Elashoff, D., Park, N. H., Wong, D. T.: Clin. Cancer Res., 10, 8442 (2004).
10) Zhang, L., Farrell, J. J., Zhou, H., Elashoff, D., Akin, D., Park, N. H., Chia, D., Wong, D. T.: Gastroenterology, 138, 949 (2010).
11) Porto-Mascarenhas, E. C., Assad, D. X., Chardin, H., Gozal, D., De Luca Canto, G., Acevedo, A. C., Guerra, E. N.: Crit. Rev. Oncol. Hematol., 110, 62 (2017).
12) Barnes, V. M., Teles, R., Trivedi, H. M., Devizio, W., Xu, T., Mitchell, M. W., Milburn, M. V., Guo, L.: J. Dent. Res., 88, 851 (2009).
13) Barnes, V. M., Ciancio, S. G., Shibly, O., Xu, T., Devizio, W., Trivedi, H. M., Guo, L., Jönsson, T. J.: J. Dent. Res., 90, 1293 (2011).
14) de Oliveira, L. R., Martins, C., Fidalgo, T. K., Freitas-Fernandes, L. B., de Oliveira Torres, R., Soares, A. L., Almeida, F. C., Valente, A. P., de Souza, I. P.: J. Proteome Res., 15, 2491 (2016).
15) Sakanaka, A., Kuboniwa, M., Katakami, N., Furuno, M., Nishizawa, H., Omori, K., Taya, N., Ishikawa, A., Mayumi, S., Tanaka Isomura, E., Shimomura, I., Fukusaki, E., Amano, A.: Front. Mol. Biosci., 8, 742002 (2021).
16) Khurshid, Z., Zafar, M. S., Khan, R. S., Najeeb, S., Slowey, P. D., Rehman, I. U.: Adv. Clin. Chem., 86, 23 (2018).
17) Kaur, J., Jacobs, R., Huang, Y., Salvo, N., Politis, C.: Clinical oral investigations, 22, 633 (2018).
18) Assad, D. X., Mascarenhas, E. C. P., de Lima, C. L., de Toledo, I. P., Chardin, H., Combes, A., Acevedo, A. C., Guerra, E. N. S.: Int. J. Clin. Oncol., 25, 1016 (2020).
19) Ishikawa, S., Sugimoto, M., Edamatsu, K., Sugano, A., Kitabatake, K., Iino, M.: Oral Dis., 26, 35 (2020).
20) Bel’skaya, L. V., Sarf, E. A., Shalygin, S. P., Postnova, T. V., Kosenok, V. K.: J. Oral Biosci., 62, 212 (2020).
21) Panneerselvam, K., Ishikawa, S., Krishnan, R., Sugimoto, M.: Metabolites, 12, 436 (2022).
22) Hirayama, A., Kami, K., Sugimoto, M., Sugawara, M., Toki, N., Onozuka, H., Kinoshita, T., Saito, N., Ochiai, A., Tomita, M., Esumi, H., Soga, T.: Cancer Res., 69, 4918 (2009).
23) Satoh, K., Yachida, S., Sugimoto, M., Oshima, M., Nakagawa, T., Akamoto, S., Tabata, S., Saitoh, K., Kato, K., Sato, S., Igarashi, K., Aizawa, Y., Kajino-Sakamoto, R., Kojima, Y., Fujishita, T., Enomoto, A., Hirayama, A., Ishikawa, T., Taketo, M. M., Kushida, Y., Haba, R., Okano, K., Tomita, M., Suzuki, Y., Fukuda, S., Aoki, M., Soga, T.: Proc. Natl. Acad. Sci. USA, 114, e7697 (2017).
24) Ishikawa, S., Sugimoto, M., Kitabatake, K., Sugano, A., Nakamura, M., Kaneko, M., Ota, S., Hiwatari, K., Enomoto, A., Soga, T., Tomita, M., Iino, M.: Sci. Rep., 6, 31520 (2016).
25) Löser, C., Fölsch, U. R., Paprotny, C., Creutzfeldt, W.: Pancreas, 5, 119 (1990).
26) Gerner, E. W., Meyskens, F. L., Jr.: Nat. Rev. Cancer, 4, 781 (2004).
27) Dejure, F. R., Eilers, M.: Embo J., 36, 3409 (2017).
28) Tsutsui, H., Mochizuki, T., Inoue, K., Toyama, T., Yoshimoto, N., Endo, Y., Todoroki, K., Min, J. Z., Toyo’oka, T.: Anal. Chem., 85, 11835 (2013).
29) Takayama, T., Tsutsui, H., Shimizu, I., Toyama, T., Yoshimoto, N., Endo, Y., Inoue, K., Todoroki, K., Min, J. Z., Mizuno, H., Toyo’oka, T.: Clin. Chim. Acta, 452, 18 (2016).
30) Asai, Y., Itoi, T., Sugimoto, M., Sofuni, A., Tsuchiya, T., Tanaka, R., Tonozuka, R., Honjo, M., Mukai, S., Fujita, M., Yamamoto, K., Matsunami, Y., Kurosawa, T., Nagakawa, Y., Kaneko, M., Ota, S., Kawachi, S., Shimazu, M., Soga, T., Tomita, M., Sunamura, M.: Cancers (Basel), 10, (2018).
31) Murata, T., Yanagisawa, T., Kurihara, T., Kaneko, M., Ota, S., Enomoto, A., Tomita, M., Sugimoto, M., Sunamura, M., Hayashida, T., Kitagawa, Y., Jinno, H.: Breast Cancer Res. Treat., 177, 591 (2019).
32) Kuwabara, H., Katsumata, K., Iwabuchi, A., Udo, R., Tago, T., Kasahara, K., Mazaki, J., Enomoto, M., Ishizaki, T., Soya, R., Kaneko, M., Ota, S., Enomoto, A., Soga, T., Tomita, M., Sunamura, M., Tsuchida, A., Sugimoto, M., Nagakawa, Y.: Cancer Sci., 113, 3234 (2022).
33) Okuma, N., Saita, M., Hoshi, N., Soga, T., Tomita, M., Sugimoto, M., Kimoto, K.: PLoS One, 12, e0183109 (2017).
34) Ishikawa, S., Sugimoto, M., Kitabatake, K., Tu, M., Sugano, A., Yamamori, I., Iba, A., Yusa, K., Kaneko, M., Ota, S., Hiwatari, K., Enomoto, A., Masaru, T., Iino, M.: Amino Acids, 49, 761 (2017).
35) Kawanishi, N., Hoshi, N., Masahiro, S., Enomoto, A., Ota, S., Kaneko, M., Soga, T., Tomita, M., Kimoto, K.: Clin. Chim. Acta, 489, 41 (2019).
36) Sugimoto, M., Saruta, J., Matsuki, C., To, M., Onuma, H., Kaneko, M., Soga, T., Tomita, M., Tsukinoki, K.: Metabolomics, 9, 454 (2013).
37) Sugimoto, M., Ota, S., Kaneko, M., Enomoto, A., Soga, T.: Bio Protoc., 10, e3797 (2020).
38) Tomita, A., Mori, M., Hiwatari, K., Yamaguchi, E., Itoi, T., Sunamura, M., Soga, T., Tomita, M., Sugimoto, M.: Sci. Rep., 8, 12075 (2018).
39) Lau, C., Kim, Y., Chia, D., Spielmann, N., Eibl, G., Elashoff, D., Wei, F., Lin, Y. L., Moro, A., Grogan, T., Chiang, S., Feinstein, E., Schafer, C., Farrell, J., Wong, D. T.: J. Biol. Chem., 288, 26888 (2013).
40) Lau, C. S., Wong, D. T.: PLoS One, 7, e33037 (2012).