【トピックス】
シンクロトロン光照射による紅麹菌の二次代謝産物生産能の改良
後藤正利、Sittichoke Ketkaeo
佐賀大・農/鹿児島大院・連合農
1.はじめに
紅麹菌は、中国、東南アジア、沖縄で伝統的な発酵食品の製造に用いられるMonascus属糸状菌である。近年は、本菌が有用な機能性を示す二次代謝産物を生産することから、米に繁殖させた紅麹が食品のサプリメントとして世界で広く販売されている。有用な二次代謝産物として、紅麹色素やモナコリン K (MK) がよく知られている。赤色、橙色、黄色の化合物を含む紅麹色素は、抗酸化作用を示す食品の着色料として利用されている1)。MK はロバスタチンとも呼ばれ、コレステロール値の低下作用や血圧上昇を抑制する作用を示すスタチンの類縁化合物である2)。一方、紅麹菌が生産する二次代謝産物としてシトリニン (CT) が知られている。CTは腎毒性を示すカビ毒であり3)、欧州食品安全機関(EFSA)により2012年に食品利用での基準値が 2000 µg/kg麹 と設定され4)、その後、2019 年に基準値が 100 µg/kgへ変更されている。
微生物による大量の物質生産を意図する場合、その目的達成手段の一つが育種改良である。遺伝子組換えにより微生物の物質生産性を向上させる方法は、改良のゴールへ意図した通りに比較的短期間で到達できる可能性が高い。しかし、食品に利用する微生物に対しての遺伝子組換え法の適用は、消費者から忌避される可能性も高い。従来からの微生物変異誘導法は、ランダムな遺伝子中の塩基の変異を誘発し選抜するため、改良微生物を取得する時間は長期を要する。しかし、予期しない変異導入によって物質高生産などの新たな獲得形質が生じる仕組みを明らかにすることも期待でき、実際に食品製造微生物での適用例も多い。微生物への変異誘発では、誘発処理が行いやすい化学的な薬剤 (エチルメタンスルホン酸EMS、N-メチル-N'-ニトロ-N-ニトロソグアニジンNTG) を使用する方法、そしてUV照射等の物理的な方法を用いることが多い。実際に、著者らは紅麹菌にNTG処理やUV照射を行い紅麹菌 Monascus purpureus KUPM5株が微量生産するCTの生産性をさらに低下させた5)。この研究の実施途中で、佐賀県立九州シンクロトロン光研究センターで微生物の変異誘発を行う機会得た。シンクロトロン光照射による微生物の育種改良については、酵母において1例6) の報告があるのみで、ゲノム解析に基づく変異塩基についての情報はなかった。シンクロトロン光照射による変異導入の特徴をゲノム解析レベルで明らかにするために、紅麹菌7)、清酒酵母8)、珪藻を微生物材料としてシンクロトロン光照射を行った。本稿では、シンクロトロン光照射により紅麹菌 M. purpureus KUPM5株の著名な二次代謝産物であるMKの生産能を強化した株の取得および得られた変異株におけるゲノム上の変異情報について紹介する7)。
2. シンクロトロン光照射とMK高生産株のスクリーニング
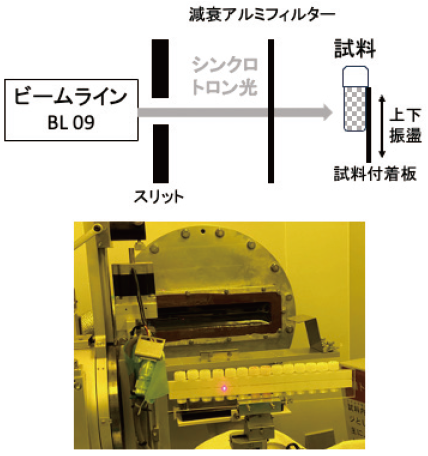
シンクロトロン光は、紫外線、極紫外線、軟X線、硬X線を含む広範な連続波長からなる放射光である9)。九州シンクロトロンセンターのビームライン9 (BL09)に導入されたシンクロトロン光をポリプロピレン製容器内の紅麹菌 M. purpureus 野生株KUPM5の胞子懸濁液に照射した (図1)。試料へのシンクロトロン光の照射エネルギー値の調整は、アルミ箔フィルターの厚さと照射時間をもとに算出して行った。シンクロトロン光が均一に照射されるように、試料をゆっくりと上下に振盪した。シンクロトロン光照射エネルギー値とKUPM5株の死滅率の関係を調べたところ、100 Gy、300 Gyでそれぞれ78.3%、96.1%であった。死滅率が96.1%に達する300 Gyの照射エネルギー量において変異導入率が高いと考え、本照射条件の試料をスクリーニングに使用した。
図1 紅麹菌胞子懸濁液のシンクロトロン光
MKは、コレステロール合成経路の初期段階のヒドロキシメチルグルタリルCoA (HMG-CoA) 還元酵素の活性阻害剤であるため2)、酵母Saccharomyces cerevisiaeのエルゴステロール合成代謝経路のHMG-CoA還元酵素の阻害剤としても働き、その生育阻害を引き起こす10)。そこで、寒天培地上で生育途中の紅麹菌変異株の上に軟寒天培地中の酵母を重層して、引き続き培養した。紅麹菌変異株が生産するMKの量が多いほど、紅麹菌コロニー周りの酵母の生育抑制に起因する大きなクリアーゾーンが形成されることを利用して、MK高生産株候補の選抜を行った。調べた紅麹菌の936コロニーから、継代培養後も形質の安定な3つの変異株SC01、SC02、SC03を取得した。
3.分離変異株の諸性質
3-1 野生株と変異株のMK生産量の比較
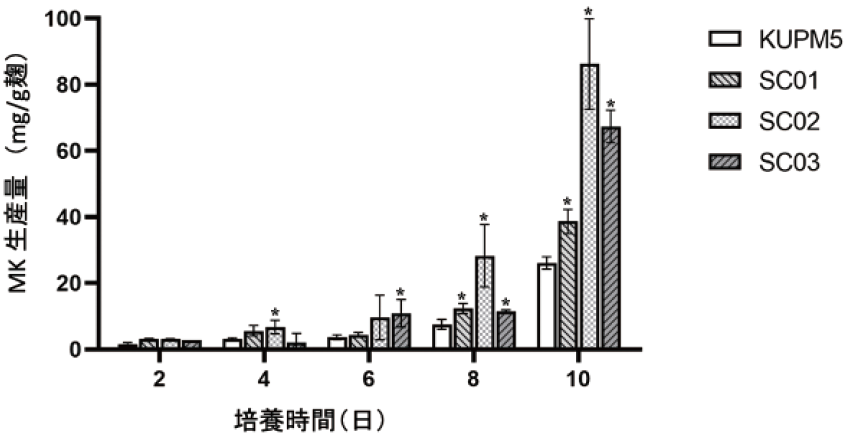
M. purpureus野生株KUPM5はタイの発酵食品Sufuから分離された紅麹色素生産能の高い菌株である5)。KUPM5株とそれから変異誘発された3種のSC変異株についての諸性質を比較した7)。ポテトデキストロース寒天培地上での、菌糸伸長の結果であるコロニーサイズは野生株と変異株では、培養1日から7日に渡って相違は認められず、同様の生育を示した。ついで、これらの菌株を蒸したインディカ米に接種して紅麹を作成して、紅麹中のMKの含有量を測定して、菌の生産量とした (図2)。MKは二次代謝産物であるため、いずれの菌株も培養8日目以降にMKを生産して、培養10日で最大生産量を示した。3つの変異株はいずれも野生株よりもMKを高生産しており、なかでもSC02株とSC03株のMK生産量は、培養10日後に親株に比べ、それぞれ約3倍、2.5倍に達した。
![]()
3-2 野生株と変異株の紅麹色素とCT生産量の比較
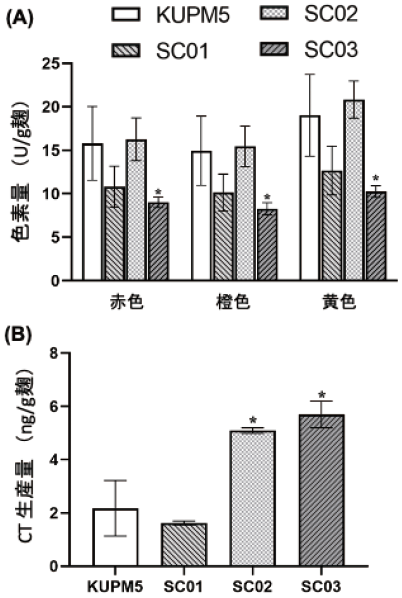
MK以外の二次代謝産物の生産性の変化について調べるために、それぞれの菌株で作成した紅麹から、紅麹色素を構成する赤色成分、橙色成分、黄色成分の量を分光学的に測定した7)。その結果、SC03株において、3種の色素成分は低下しているが、SC01株とSC02株では、親株と相違がなかった (図3(A))。さらに別の二次代謝産物であるCTの生産量についても調べた。野生株KUPM5のCTの麹中の含有量は、EU基準値の1/50程度と低レベルではあるが、MKの生産能が高いSC02株とSC03株においては共に親株に比べ2、3倍の値を示した (図3(B))。これらの変異株SC02とSC03は、二次代謝産物MKとCTの生産量の向上という点で共通性が認められ、共通の生産制御機構に関わる遺伝子の変異の可能性が示唆された。一方、紅麹色素については、MKの生産量増強とは全く関係していないことが示唆された。

3-3 親株と変異株のα-アミラーゼ活性、麹中の菌体量の比較
変異株がMKを高生産することになっても、通常の麹が作成できなければ利用が困難である。デンプンを多量に含む米での増殖に必須なα-アミラーゼ活性と麹中での紅麹菌株の増殖を比較した7)。α-アミラーゼ活性については、親株に比べ、いずれのSC変異株も高活性を示し、栄養素としての糖の供給の観点から、変異株は麹作成に支障はないと判定された。紅麹中の変異株の菌体量について、米には含まれない麹菌に特有な細胞壁キチンの構成糖であるN-アセチルグルコサミン量を指標に、野生株と比較した。その結果、SC01、SC02については菌体量に相違が見られなかったが、SC03株において有意に菌体量が減少していた。以上の結果から、最もMK生産量が高く、紅麹色素を野生株と同程度生産し、麹中で良好に生育するSC02株が、最も紅麹としての利用に適した株であると考えた。
4.M. purpureus野生株KUPM5とSC変異株のゲノム情報
4-1 野生株と変異株のゲノム情報
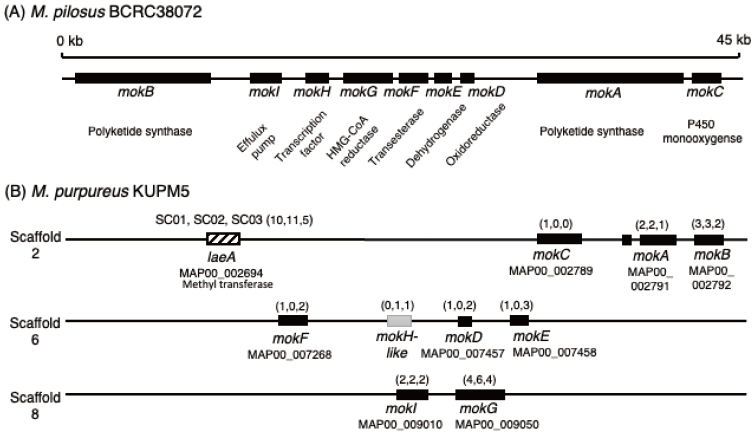
シンクロトロン光照射による変異塩基を明らかにするために、M. purpureus野生株KUPM5と3種のSC変異株のゲノム解析を実施した7)。その結果、基準となる野生株において、最終的に10のコンティグ情報を得た。Monascus属糸状菌の染色体数は8本であるため、KUPM5株のゲノム解析においては、ミトコンドリアDNAを除くと染色体1本が断片化された、ほぼ完全なゲノム情報を得た (図4)。KUPM5株の全ゲノムサイズは、24.5 Mb、GC含量は48.9%であり、総遺伝子数は9,270と予測された。真核生物における個々遺伝子の配置は、同じ代謝に関係していても、互いに異なった染色体上や同一の染色体上の離れた位置に散在しているのが一般的である。しかし、MK、紅麹色素、CTなどの二次代謝物質の合成に関わる複数の遺伝子群は、原核生物である細菌の遺伝子と同様に染色体上においてクラスターとしてまとまって存在する。実際にM. pilosus BCRC38072株のMK合成に関わるmok遺伝子群は、1つの染色体上にまとまって存在する11)(図4(A))。一方、KUPM5株では、mok遺伝子群は3つの染色体 (ゲノム解析上のスキャフォールド) に分散していることが明らかになった (図4(B))。細菌が保有していた祖先型mok遺伝子群が水平伝播によってMonascus属の祖先に移り、その後M. purureus KUPM5株においてはmok遺伝子の再編成が起こったのではないかと推察している。

4-2 変異株における MK合成遺伝子群での変異点
SC変異株はMKの生産量が向上しているため、MKの多段階にわたる合成反応に関与する酵素群、細胞外への排出、そして遺伝子群全体の発現制御に関与するmok遺伝子群について、SC変異株のタンパク質をコードしている配列 (CDS) 内の変異塩基を調べた7)。SC変異株のmok遺伝子内に見られる変異はいずれも塩基置換によるもので、いずれのSC変異株においても、いずれかのmok遺伝子に1~6塩基の置換が認められた (図4(B))。それらの塩基置換のうち、タンパク質中のアミノ酸の変化を生じる塩基置換は、SC03株の脱水素酵素をコードするmokE遺伝子においてのみ見つかった。従って、SC02株やSC03株の高いMK生産能は、mok遺伝子群内のタンパク質構造の変化以外に起因することが示唆された。個々のmok遺伝子のCDSの上流配列 (five prime untranslated region: 5’UTR) と下流配列 (3’UTR) は、それぞれ遺伝子の転写調節と転写物mRNAの安定性に関与しており、最終的な遺伝子産物であるタンパク質の合成量へ影響を及ぼす。3種のSC変異株共通に、ポリケチド合成酵素をコードするmokA及びmokB、HMG-CoA還元酵素をコードするmokG、輸送体をコードするmokIの5’UTR及び3’UTRにおいて複数の塩基置換が存在するため、これらの遺伝子の発現量の変化の可能性が示唆された7)。
SC02株とSC03株は共にMKとCTの生産量が2.5倍以上増加していた。二次代謝産物の生合成を正に制御するグローバル制御因子として、糸状菌のメチルトランスフェラーゼをコードするlaeA遺伝子が知られている12)。LaeAの活性化によって、複数の二次代謝物質の生合成系が同時に促進されることが可能である。SC変異株においては、laeA遺伝子のタンパク質コード配列中にmok遺伝子群よりも多い5から11塩基の変異、そして5’UTR及び3’UTR中にも変異が認められる (図4(B))7)。SC02株とSC03株のMKや CTの生産量が増加している要因として、変異によりLaeAの発現量が上昇することで、これらの二次代謝産物の生産量が共に増加している可能性も排除できない。
5.シンクロトロン光照射による紅麹菌の変異の特性
シンクロトロン光照射後の紅麹菌全ゲノムにわたる変異に関する特性について調べた7)。シンクロトロン光照射によるSC変異株への変異様式は、3つのSC変異株間でいずれも同一の傾向を示したことから、M. purpureus KUPM5株にシンクロトロン光を照射した時の特性を示していると考えられる。3株の平均的な変異様式は、高割合なものから一塩基置換 (SNV、69%)、一塩基挿入 (Insertion、18%)、一塩基欠損 (Deletion、11%) でありSNV、InDel (Insertion及び Deletion) を含む一塩基置換が大部分を占めた。複数塩基にわたる変異は、複数塩基置換 (MNV、1%)、複数塩基挿入欠損変異 (Multiple nucleotides InDels、1%) とわずかな割合であった。紅麹菌変異株でのInDelの割合が、29%と比較的高頻度である点は特徴の一つである。コーディング配列上のInDelは、3塩基ずつアミノ酸へと翻訳される際に読み枠が1塩基分ずれ、タンパク質中のアミノ酸組成の変化やタンパク質合成の途中での終了を引き起こし、それに伴う活性の変化をもたらすことが示唆される。したがって、紅麹菌へのシンクロトロン光照射は、高頻度に遺伝子産物タンパク質の機能へ影響をおよぼす可能性がある。
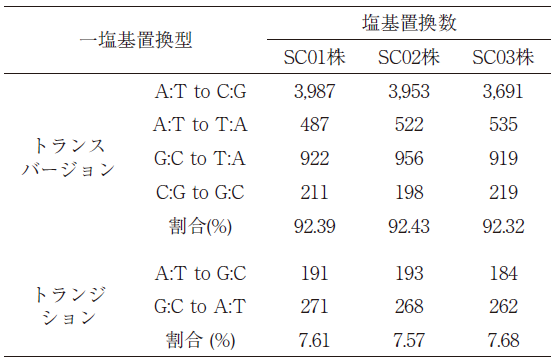
ついで、最も高頻度に見られたSNVの内訳を調べた。プリン塩基 (A、G) あるいはピリミジン塩基 (C、T) が、それぞれピリミジン塩基、プリン塩基へと塩基構造の劇的な変化が生じるトランスバージョン変異が92%、プリン塩基あるいはピリミジン塩基が、それぞれプリン塩基、ピリミジン塩基のままのトランジション変異がわずか8%であった (表1)。特にA:T→C:Gへのトランスバージョン変異は全SNV変異の66%を占める特徴を示した。本シンクロトロン光照射実験では、同時に清酒酵母に対しても実施され、様々な香味成分を生産可能な酵母の育種とゲノム解析による変異様式が決定された8)。酵母での変異では、全一塩基変異様式に占めるInDelの割合は8-21%と紅麹菌の29%よりも低く、逆にSNVの割合が高く79-92%を占めた。そのSNVパターンは、G:C→A:T、A:T→G:Cつまりトランジション変異が65%ほどを占め、トランスバージョン変異の割合が低かった。紅麹菌及び清酒酵母へのシンクロトロン光照射条件は、共におよそ96%の死滅率を示した300 Gyの同条件で行ったが、ともに子嚢菌類に属する2つの真菌においてSNVの高頻度変異様式は異なっていた。子嚢菌門と担子菌門に含まれる酵母の継代培養による変異誘発後の変異様式についての報告があり、酵母の種によって変異様式が大きくなっていることが示されている13)。これらの酵母の細胞内のトリグリセリド、抗酸化物質、カロテノイドの含有量によって、変異様式に影響を及ぼすことが示唆されている。したがって、紅麹菌の高頻度なA:T→G:Cトランジション変異が、シンクロトロン光の直接的な作用に起因するものではないことを示している。塩基置換は最終的にDNA修復系の異常によって生じる。遺伝子修復に関与する大腸菌のmutT、mutYや出芽酵母pcd1への変異が、A:T→G:C、C:G→A:Tの変異頻度を向上させることが報告されている14-16)。紅麹菌SC変異株では、修復系のmutTやmutYに相当する遺伝子に複数の変異が導入されており、高頻度のA:T→C:Gトランジション変異の特性を与えている可能性がある。
表1 M. purpureus SC変異株における一塩基置換型の分布
6.おわりに
紅麹菌は糸状の菌糸を形成するが、菌糸は隔壁で区切られた細胞が連なる多細胞の生物であり、また一つの細胞内に複数の核が共存する微生物である。これらの生物への変異誘発による菌株改良は変異株の安定化までを考慮すると、単細胞の酵母菌の菌株改良に比べ時間を要する。今回、MKを野生株に比べ3倍量生産する変異株SC02を取得することができたが、そのMK高生産性をいかに獲得したのかは未解明である。変異はランダムにゲノム中の全遺伝子に渡っているため、ゲノム解析だけでは責任遺伝子の判定は困難である。遺伝子発現解析、遺伝子破壊などの手法を駆使して、責任遺伝子の同定によって新たな高生産要因が判明することを期待している。一方、SC02株のCT生産量も、食品利用での基準値以下ではあるが、増強されていた。現在、ゲノム編集が微生物から高等生物の育種に利用が盛んになっている。CT合成遺伝子群も既に明らかなので、ゲノム編集によりピンポイントでCT生産能だけを失わせた株を作成しているところである。シンクロトロン光照射は、使用例こそ少ないが、応用微生物学が始まって以来、永年使用されている物理的変異誘発手法の一つであり、微生物の機能性や物質生産量などの有用化への変異誘発手段としては、極めて有効であることを示すことができた。今後は、この馴染みのある変異誘発技術と最新のゲノム編集が共に利用され、最終目的である微生物の育種改良に利用されていくと考える。
謝辞
本研究でのシンクロトロン光照射実験は、佐賀県立九州シンクロトロン光研究センターにて実施し、同センターの石地耕太朗博士、佐賀大学木村圭准教授、小林元太教授の協力をいただいた。ゲノム解析は、佐賀大学総合分析実験センターの永野幸生准教授に協力いただいた。ご協力いただいた皆様に感謝申し上げます。
文献
1) Feng, Y., Shao, Y., Chen, F.: Appl. Microbiol. Biotechnol., 96, 1421 (2012).
2) Xiong, Z., Cao, X., Wen, Q., Chen, Z., Cheng, Z., Huang, X., Zhang, Y., Long, C., Zhang, Y., Huang, Z.: Food Chem. Toxicol., 131, 110585 (2019).
3) Liu, B. H., Wu, T. S., Su, M. C., Chung, C. P., Yu, F. Y.: J. Agric. Food Chem., 53, 170 (2005).
4) European Food Safety Authority (EFSA).: EFSA J., 10, 1(2012).
5) Ketkaeo, S., Sanpamongkolchai, W., Morakul, S., Baba, S., Kobayashi, G., Goto, M.: J Gen Appl Microbiol., 66, 163 (2020).
6) 三井 俊、伊藤彰敏、杉山信之、榊原康彰、船井秀哉、水野善文、木村伸一、小栗宏次、山本晃司: あいち産業科学技術総合センター 研究報告, 44 (2018).
7) Ketkaeo, S., Nagano, Y., Baba, S., Kimura, K., Futagami, T., Sanpamongkolchai, W., Kobayashi, G., Goto, M.: J Biosci Bioeng., 133, 362 (2022).
8) Baba, S., Hamasaki, T., Sawada, K., Orita, R., Nagano, Y., Kimura, K., Goto, M., Kobayashi, G.: J. Biosci. Bioeng., 132, 265 (2021).
9) Margaritondo, G., Hwu, Y., Je, J. H.: Riv. Nuovo Cim., 27, 1e40 (2004).
10) Vilches, F. M. A., Casas López, J. L., Sánchez Pérez, J. A., Fernández Sevilla, J. M., Chisti, Y.: World J. Microbiol. Biotechnol., 21, 123 (2005).
11) Chen, Y. P., Tseng, C. P., Liaw, L. L., Wang, C. L., Chen, I. C., Wu, W. J., Wu, M. D., Yuan, G. F.: J. Agric. Food Chem., 56, 5639 (2008).
12) Bok, J. W., Keller, N. P.: Eukaryotic Cell, 3, 527 (2004).
13) Long, H., Behringer, M. G., Williams, E., Te, R., Lynch, M.: Genome Biol. Evol., 8, 3815 (2016).
14) Nunoshiba, T., Ishida, R., Sasaki, M., Iwai, S., Nakabeppu, Y., Yamamoto, K.: Nuc. Acids Res., 32, 5339 (2004).
15) Fowler, R. G., Schaaper, R. M.: FEMS Microbiol. Rev., 21, 43 (1997).
16) Foster, P. L., Lee, H., Popodi, E., Townes, J. P., Tang, H.: Proc. Natl. Acad. Sci. USA, 112, E5990 (2015).