【トピックス】
光絶対測定に基づく生物発光反応の発光量子収率と発光強度
丹羽一樹
産総研・物理計測標準
1.はじめに
ホタルの光は極めて効率が良く、エネルギーのほぼ全てを光に変換して熱を発しないため、「冷光」とすら言われている。ホタルのように自ら光る生物は、酵素反応である生物発光反応 (あるいは生物発光) により光を作り出している。発光反応の基質をルシフェリン、酵素をルシフェラーゼと言い、発光反応はルシフェリン‐ ルシフェラーゼ反応とも呼ばれている。光る生物のグループごとに基質ルシフェリンの分子構造が異なるため、例えばホタルルシフェリン、ウミホタルルシフェリン、のように生物種を冠して称することもある。腔腸動物の発光反応系の場合は、セレンテラジン (Coelenterazine) を基質とするものが多いが、これもルシフェリンの一種である。尚、GFPに代表される蛍光タンパク質は光るクラゲなど腔腸動物をはじめとする多くの海洋生物においてエミッターとして機能しているが、発光基質や酵素ではないので生物発光反応とは切り離して議論されることもある。そもそも蛍光タンパク質は、自ら光を発しない生物 (サンゴなど) にも見られる。
現在では生物発光はバイオマーカとして多方面で応用されている。そのメリットは対象物質を高感度で検出できることにある。これは発光という現象そのものが特異であるためにバックグラウンドノイズが極めて小さく、S/N比の高い測定が可能なためである。生物発光による分析システムでは、発光シグナルが強いほど高感度な検出が可能となるため、より明るい発光反応系が求められる。また異なる発光色を応用すれば、同時に複数の対象を分析できる。そのため発光強度や発光色を改良する目的でこれまでにも酵素ルシフェラーゼの改変や基質ルシフェリンのアナログ開発など多くの研究が行われている。ここでは発光反応の明るさと酵素活性の関係に着目し、発光強度の絶対値計測に基づいた酵素活性の定量的評価について紹介する。特に「ほぼ全てのエネルギーを光に」とまで言われる根拠となったホタルの発光反応量子収率に焦点を当て、研究の歴史と背景を含めて解説する。
2.絶対光測定による生物発光反応の定量的評価
2-1 量子収率の背景と歴史
ホタルに代表される生物発光は古くから人々の興味を惹く魅力的な自然現象であり、上述の「冷光」という言葉はアリストテレス (前384~322年) の記載による。ボイルの法則で知られるロバート・ボイルは1667年、発光バクテリアによる朽木の発光に空気が必須であることを実験的に示している。しかしこの時代には微生物も酸素も発見されておらず、化学的に正確な解釈が十分にされたとは言い難い。微生物はレーウェンフックが1674年に発見し、酸素は1774年にジョゼフ・プリーストリーが発見している。生物による発光がある種の化学反応によるものであることが認識されるようになるのは19世紀のことである。19世紀は酵素研究の黎明期であるが、1885年にラファエル・ドュボアが発光甲虫から発光基質と発光酵素を見出し、それぞれルシフェリンとルシフェラーゼと名付けた。これもまた、酵素の実体がタンパク質であることが広く認められるようになる20世紀前半よりも前のことである。
ルシフェラーゼの遺伝子は1985年にクローニングされ、1987年にその塩基配列をもとにアミノ酸配列が報告されている1,2)。今ではルシフェラーゼはアシルCoA合成酵素 (E.C.6.2.1.3) と相同性があり、それらが遺伝的起源であると考えられるようになったが、当時はまったくの新規配列であった。そのため2年後の1989年に植物からクマル酸CoA合成酵素がクローニングされた際には、ルシフェラーゼのホモログとして報告されている3)。その後しばらくこれらアシルCoA合成酵素群はLuciferase like enzyme、Luciferase familyなどと報告されていた。このように生物発光の研究記録は常に時代を先取り、後世に加筆・修正を加えられながら理解が進んできた。
ホタルの生物発光の効率の良さは広く知られているが、その実験的根拠は発光反応量子収率 (φBL) が0.88±0.25というものである。これの意味するところはルシフェリン1分子が反応すると88%の確率で光量子が1つ発生し、残りの約1割は熱になるというものである。この報告は米国Johns Hopkins大のMcElroyらのグループによる1959年のものである4)。その後、GFPの発見で後にノーベル賞を受賞する下村博士が1962年にウミホタルのφBL = 0.28を5)、更に1986年にイクオリンのφBL = 0.23 (後にφBL = 0.17に修正) を報告している6,7)。セレンテラジンを基質ルシフェリンとして発光するウミシイタケ (Renilla) のφBL = 0.069は2010年にLoeningらが報告した8)。またホタルのφBL = 0.88を報告した米国のグループは1965年にルミノールのφBL = 0.012を報告し、これは後に光量子測定系を検証するための事実上の標準実験と位置づけられるようになった9)。
これらの中でもホタルのφBL = 0.88は群を抜いて高い値である。しかし米国のグループが1959年に発表してからこの値は全く追試されてこなかった。更に当時はルシフェリンの構造も未解明で、実験に用いられたルシフェリンは天然のホタルから精製されたものである。彼らがルシフェリンの化学構造を報告したのは2年後の1961年である10)。そこには不斉炭素が含まれていて、化学合成により発光基質になるのが片方の光学異性体であることを明らかにしている。彼らは同時に天然のホタルから精製したルシフェリンが恐らく精製の過程でラセミ化していたと報告している11)。すなわち、量子収率測定実験に使用された基質ルシフェリンは天然から精製したラセミ体であり、消費された基質分子は想定のおよそ半分ということになり、量子収率の値は2倍に修正する必要がある。しかしこれではφBLが100%を超えることになり、理論的に不可能である。
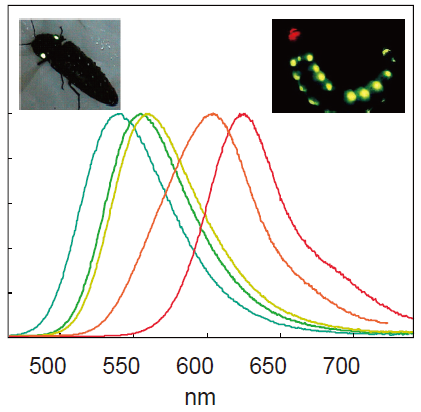
また、1959年のホタル発光反応の量子収率測定には、北米に棲息するホタル (いわゆる北米産ホタル、Photinus pyralis) から精製したルシフェラーゼが用いられていた。しかし、ホタルを含む発光甲虫は多様で、例えば幼虫の頭部が赤く体側が黄緑色に光るブラジルの鉄道虫 (Phrixothrix hirtus)12)のように、異なる発光色を持つ種が知られている (図1)。これら発光甲虫においても、発光基質ルシフェリンの化学構造は共通である。また、アミノ酸配列の改変により発光色の異なる変異ルシフェラーゼも数多く開発されている。それらは同じ基質分子を反応させているにもかかわらず、発光色はルシフェラーゼの種類によって変化し、更にはpHなどの反応条件によっても変化する。しかしそれらの多様な発光反応のφBLは、いずれも不明なままであった。

このように発光反応の明るさに関わる重要な指標であるφBLデータの充実が求められるなか、我々は生物発光のφBLの精密な測定を行った。
2-2 光量子数の絶対計測に基づく量子収率の測定
上に述べたように、φBLは基質1分子が光量子を1つ放出する確率と定義されており、式1で表される。ここでφReは反応効率、φS*は一重項励起分子生成効率、φFLは蛍光量子収率、NSは基質分子数、Nhνは生成光量子数である。
φBL = φRe × φS* × φFL = Nhν / NS (式1)
量子収率を実験的に求めるためには生成する光量子の数Nhνを定量する必要があり、そのためには光の絶対計測が必要となる。光は可視域の電磁波であり、その絶対量はエネルギーあるいはパワー (単位時間当たりのエネルギー) で表され、単位はそれぞれジュール (J)、ワット (W) である。光量子は光の最小単位であり、式2によりエネルギー量に変換できる (hはプランク定数、νは振動数、cは光速、λは波長)。
E = hν= hc / λ (式2)
光の絶対値を測定するデバイスにパワーメータがある。光の波長ごとに応答度が校正されたパワーメータはレーザのような単色で、かつ指向性の高い光の絶対測定に適している。一方、生物発光反応溶液からの光のスペクトルは幅広く、レーザのように単色ではない。また拡散光のため指向性がない。そのため、パワーメータを頼りとして生物発光の絶対値を測定するためには、複雑で高度な校正を何段階も積み重ねる必要がある。
2008年、東大の秋山らのグループはパワーメータを用いて分光測定装置を校正し、更に拡散光の利用効率を校正した発光反応測定容器を考案し、発光反応の絶対測定系を構築した13)。これを用いて北米産ホタルのルシフェラーゼによる発光反応量子収率の再評価を行い、φBL = 0.41という結果を得た14)。この結果は1959年の結果φBL = 0.88の約半分であった。
そこで我々は、北米産ホタルのルシフェラーゼによるφBL の更なる検証を行うとともに測定発光色の異なる他の発光甲虫のルシフェラーゼなど、多様なサンプルのφBL評価を行うため、全く独立した校正体系に立脚した測定システムを構築することとした。システムを構築するにあたり我々は、生物発光を応用した分析システムなどで広く使用されている発光測定装置 (ルミノメータ、プレートリーダなど) の絶対感度を校正し、発光反応の定量測定のアクセシビリティを向上させることで、より多くのφBL 実験を行えるようにすることとした。絶対値を測定するための光計測標準としても、パワーメータとは異なる計量トレーサビリティを持つ標準電球を用いることで、計測システムのより高い独立性を実現することとした。
ルミノメータなどの絶対感度校正を行う最もシンプルな方法は、絶対発光量が明らかで定常的に発光するリファレンス光源を標準として使用することである。このリファレンス光源は、形状そしてスペクトルともに発光試薬と同じでなくてはならない。形状が異なると光検出素子 (光電子増倍管など) に到達する光量子数が変わる。またどのような光検出器にも分光感度特性があり、光源のスペクトルによって感度が変わるためである。この課題については量子収率測定を行う発光反応溶液の組成を工夫することで、定常的に発光する良好なリファレンス光源を調整することで解決できる。問題は、このリファレンス光源の絶対発光量を決定する方法である。
我々は光放射量の国家標準を維持・管理する産総研の計量標準の絶対光計測技術を活用し、積分球と分光測定装置、そして標準電球を用いた発光反応溶液のための絶対分光測定システムを構築した (図2)。積分球は内面が拡散反射剤 (硫酸バリウム粉末) で塗装されており、球内の光の方向と強度が平滑化される。これを用いることで、球内の光源から全空間方向に放出される全光子と、壁面の穴を通して外部から直線的に導入した光を同等に測定することができる。

まず、積分球式分光測定装置の絶対分光感度を分光放射照度標準電球により校正した。この標準電球は、50 cmの距離における分光放射照度 (W nm-1 cm-2) という絶対値が各波長で値付けられており、図2の測定装置の絶対感度を分光的に校正できる。次にリファレンス光源となる発光溶液の発光量再現性に対する懸念を除くため、調製した発光溶液を二つに取り分け、積分球とルミノメータで同時に測定し、リファレンス発光溶液の総光子数とルミノメータに表示される測定値 (カウント値) の関係からルミノメータ絶対感度を決定した。最後に、絶対感度が校正されたルミノメータを用いて、発光反応量子収率を測定した15)。
2-3 量子収率と発光反応の明るさ
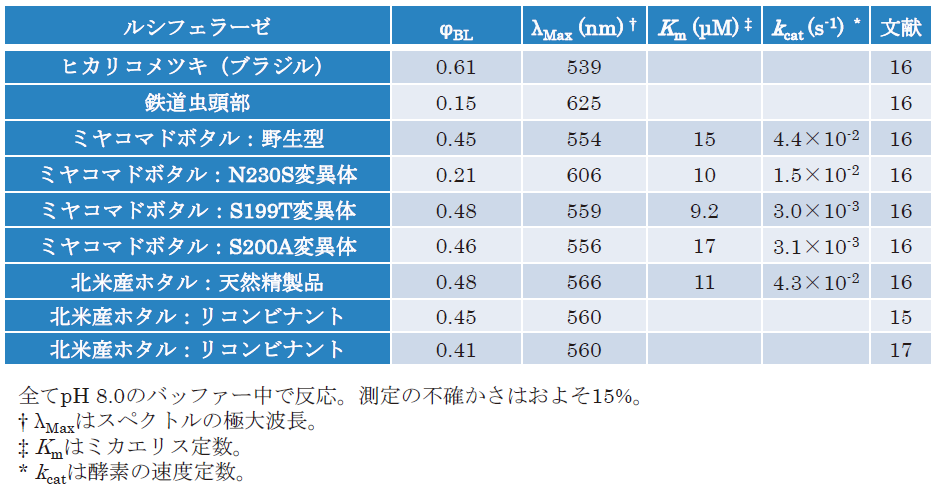
表1に代表的なφBL測定結果をまとめた。北米産ホタルのφBLは、天然精製品も大腸菌によるリコンビナント発現精製品も、どちらもともに秋山らの結果とほぼ同じであった。その後も同様の測定を行っており、再現性も確認できている17)。トレーサビリティの異なる互いに独立した絶対値計測システムを用いてほぼ同じ結果が得られたことから、これらの結果の妥当性が示されたと言える。
表1 ホタル発光反応の各種ルシフェラーゼによる量子収率φBL
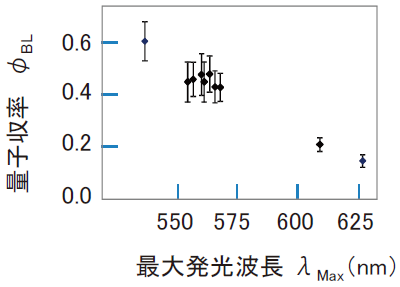
表1の結果を発光波長とφBLの関係にまとめると図3のようになる16)。これから明らかなように、発光極大波長が短い (青い) 酵素ほど量子収率は高く、最大であったのはブラジルのヒカリコメツキ (Pyrearinus termitilluminans) のφBL = 0.61であった。1959年に報告されたφBL = 0.88には及ばないが、ヒカリコメツキのφBL = 0.61もやはりかなりの効率の良さであり、今のところこれを超える効率の良い発光反応系は報告されていない18)。逆に量子収率が最も低かったのは最も波長が長い (赤い) 鉄道虫の0.15であった。

興味深いのは、一連のアミノ酸変異ルシフェラーゼでも量子収率φBLの値が図3の関係を維持していることである。ミヤコマドボタル (Luciola mingrelica) の野生型ルシフェラーゼとアミノ酸変異ルシフェラーゼでは、酵素濃度を同じにしても変異導入により反応液の明るさが著しく低下するが、それでも量子収率φBLは大きく変わらなかった16)。このことから以下のように、反応液の明るさの低下は酵素反応速度論的な要因であることが示唆される。
発光反応の明るさIlmは、次のとおり発光量子収率φBLと反応速度Vの積で表される。
Ilm = φBL・V (式3)
反応速度Vは酵素反応速度論から式4となる。
V=VMax / (1+Km / [S])=kcat・[E]/(1+Km / [S]) (式4)
ここでVMaxは最大反応速度、Kmはミカエリス定数、[S]は基質濃度、kcatは酵素の速度定数、[E]は酵素濃度である。通常、基質濃度[S]はミカエリス定数Kmに比べ十分に大きいので式3および式4より
Ilm = φBL・kcat・[E] (式5)
となり、生物発光反応溶液の明るさIlmは、量子収率φBLと酵素反応速度定数kcat 、そして酵素濃度[E]の単純な積で表すことができる。ミヤコマドボタルのルシフェラーゼとその変異体ではφBLは最大でも2倍程度の違いであった (Kmも大きな差はない)。これに対しkcatは10倍以上の開きがあった16)。これにより、ルシフェラーゼのアミノ酸変異導入により発光反応の明るさIlmが低下する要因はφBLではなくkcatにあることが示された。逆に変異導入していない野生型の場合、ルシフェラーゼのkcatの値は種によらず大きく変わらない。以上の結果は、発光反応の明るさIlmに最も寄与し得るのが酵素濃度[E]ということを指す。
ここで注意が必要なのは、酵素濃度[E]が単純な分子数としての濃度ではなく、活性のあるインタクトな酵素の濃度である点にある。ホタルのルシフェラーゼはバッファーの種類や塩濃度などの条件で活性が損なわれることが知られているが、これは酵素タンパク質の劣化による不活性化の結果、[E]が減少しているということを端的に示している。
以上の結果は、ルシフェラーゼアッセイのような生物発光による分析システムを開発する際に重要な指針となる。より明るい反応であるほど、対象物質を高感度で検出できるため、明るさIlmの最適化は生物発光による分析システムの重要な開発要素である。その際、少なくとも天然型の発光甲虫のルシフェラーゼを用いる場合は、酵素の反応条件を最適化してアクティブな酵素の濃度を上昇させることが極めて重要と言える。
3.絶対測定とバイオ分析の標準化
生物発光は遺伝子発現マーカやエンザイムイムノアッセイの検出などに応用されている。このような生物発光の例に限らず多くのバイオ分析では、生体物質の量などを蛍光、発光、あるいは吸光度の変化などの光シグナルに変換して測定している。ここで使用される分析機器や試薬等の製品の光学特性は、適切な標準光源を用いることで評価、管理が可能である。本稿で紹介したφBL測定では、発光反応溶液そのものを標準光源として使用してルミノメータの校正を行った。しかし分析機器や試薬等の特性評価や管理には、LED光源のような再現性の高い製品の方が信頼性が高く、かつ使いやすい。装置等を評価するための参照用LED光源は既に市販されており、それらの製品のいくつかは産総研における絶対値測定に基づいて管理されている。更に今年、以上のような参照用光源の使用を推奨する国際標準文書が発行されたところである19)。このように光の絶対測定技術は、生物発光反応の明るさの定量的評価を目的とした研究を出発点としつつ、生物発光を応用した分析システムの信頼性向上に貢献することにも活用されている18)。
4.おわりに
ホタルの生物発光反応については古い研究報告も多く、もう既に研究され尽くされていると思われるかもしれない。しかし歴史が古いと言うことは、主要な報告もかなり早い時期に成されているため、最新の科学の進展を踏まえて改めて見直すことで新しい展開が見込める可能性があり、課題はまだまだ残されている。生物発光研究は日本の研究者が大きな成果を残してきた分野である。このような伝統に少しでも貢献していければ幸いである。
謝辞
本研究では、産業技術総合研究所近江谷克裕首席研究員、同健康医工学研究部門中島芳浩グループ長、同物理計測標準研究部門市野善朗総括研究主幹、東大物性研究所秋山英文教授、鹿児島大学加藤太一郎助教をはじめ、多くの方々のご助力を頂きました。ここに謹んで感謝いたします。
文献
1) de Wet, J. R., Wood, K. V., Helinski, D. R., DeLuca, M.: Proc. Natl. Acad. Sci. USA, 82, 7870 (1985).
2) de Wet, J. R., Wood, K. V., DeLuca, M., Helinski, D. R., Subramani, S.: Mol. Cell. Biol., 7, 725 (1987).
3) Schröder, J.: Nucleic Acid Research, 17, 460 (1989).
4) Seliger, H. H., McElroy, W. D.: Biochem. Biophys. Res. Commun., 1, 21 (1959).
5) Johnson, F. H., Shimomura, O., Saiga, Y., Gershman, L. C., Reynolds, G. T., Waters, J. R.: J. Cell. Comp. Physiol., 60, 85 (1962).
6) Shimomura, O., Johnson, F. H.: Biochemistry, 8, 3991 (1969).
7) Shimomura, O., Johnson, F. H.: Nature, 227, 1356 (1970).
8) Loening, A. M., Dragulescu-Andrasi, A., Gambhir, S. S.: Nat. Methods, 7, 5 (2010).
9) Lee, J., Seliger, H. H.: Photochem. Photobiol., 4, 1015 (1965).
10) White, E. H., McCapra, F., Field, G. F., McElroy, W. D.: J. Am. Chem. Soc., 83, 2402 (1961).
11) White, E. H., McCapra, F., Field, G. F.: J. Am. Chem. Soc., 85, 337 (1963).
12) Viviani, V. R.: Cell. Mol. Life Sci., 59, 1833 (2002).
13) Ando, Y., Niwa, K., Yamada, N., Irie, T., Enomoto, T., Kubota, H., Ohmiya, Y., Akiyama, H.: Photochem. Photobiol., 83, 1205 (2007).
14) Ando, Y., Niwa, K., Yamada, N., Enomoto, T., Irie, T., Kubota, H., Ohmiya, Y., Akiyama, H.: Nat. Photonics, 2, 44 (2008).
15) Niwa, K., Ichino, Y., Ohmiya, Y.: Chemistry Letters, 39, 291 (2010).
16) Niwa, K., Ichino, Y., Kumata, S., Nakajima, Y., Hiraishi, Y., Kato, D., Viviani, V. R., Ohmiya, Y.: Photochem. Photobiol., 86, 1046 (2010).
17) Ikeda, Y., Saitoh, T., Niwa, K., Nakajima, T., Kitada, N., Maki, S. A., Sato, M., Citterio, D., Nishiyama, S., Suzuki, K.: Chem. Commun., 54, 1774 (2018).
18) Niwa, K., Kubota, H., Enomoto, T., Ichino, Y., Ohmiya, Y.: Biosensors, 13, 223 (2023).
19) ISO 24421:2023; Biotechnology - Minimum requirements for optical signal measurements in photometric methods for biological samples, the International Organization for Standardization: Geneva, Switzerland, (2023).