【トピックス】
テトラヒドロプテリン依存性の芳香族アミノ酸水酸化酵素を活用した微生物による有用物質生産
佐藤康治
北大院・工
1.はじめに
環境破壊や資源枯渇などの世界規模の課題解決に向け、微生物や酵素の持つ優れた物質変換能を活用した有用物質生産技術に大きな期待が寄せられている。これは従来の化学合成法と比較して、再生可能な植物由来資源 (バイオマス) を原料とする、消費エネルギーが少ない、有害な溶媒や触媒の使用を削減できるなどの利点がある。現在は「持続可能な社会を実現するための世界目標 (SDGs) 」の達成への貢献からも世界的に注目されている。
近年の代謝工学や合成生物学の目覚ましい発展により、人工代謝経路のデザインと微生物への実装によって天然化合物だけでなく非天然化合物の生産が可能になりつつある。微生物で生産可能な化合物の更なる拡大には、利用できる酵素の開拓が必須である。シーケンス解析技術の革新によってゲノム情報を容易に入手できる現在、ゲノムマイニングによる新規酵素の探索が盛んに進められる一方で、これまで産業利用が困難と考えられていた既知酵素の利活用に目を向けることも重要である。
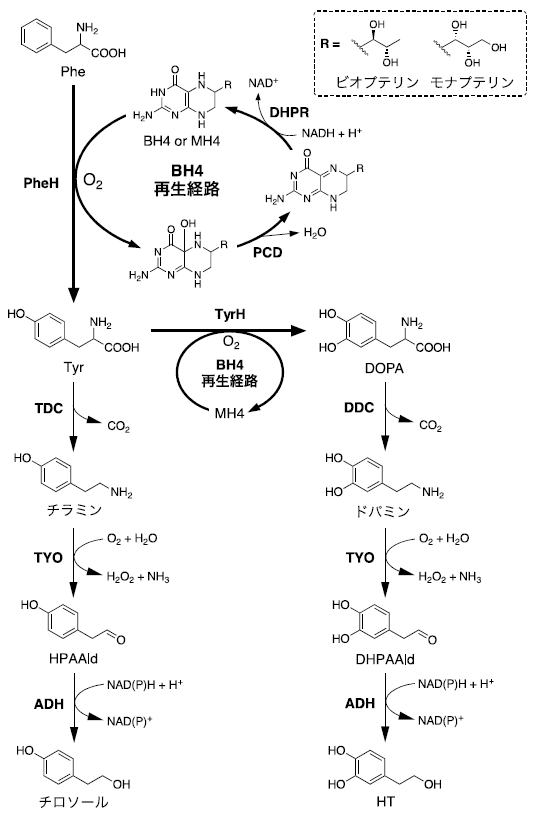
テトラヒドロビオプテリン (BH4) 依存性の芳香族アミノ酸水酸化酵素はヒトをはじめ動物に特異的な酵素で、生命維持に重要な役割をもつ。フェニルアラニン (Phe) 水酸化酵素 (PheH) は食事で摂取した過剰なPheの代謝、チロシン (Tyr) 水酸化酵素 (TyrH) およびトリプトファン水酸化酵素は神経伝達物質 (ドパミン、アドレナリン、セロトニン、メラトニンなど) の生合成に関わる (図1)1)。これらの欠損はフェニルケトン尿症や神経疾患の原因となるため、医学分野で現在も研究されている。他方、温和な条件下、ワンステップで芳香環を位置選択的に水酸化する本酵素は、産業分野からも興味がもたれた。しかし1980年代に遺伝子が発見されたにも関わらず、応用研究の報告はなかった。このような背景から、筆者らは本酵素の微生物による有用物質生産への応用は、生産可能な化学種を拡大する上で重要と考え研究を進めている。
図1 Tyrとその誘導体の合成経路
2.TyrHの利活用
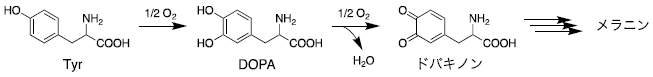
DOPA (3,4-ジヒドロキシフェニルアラニン) は、動物では神経伝達物質、植物では医薬品原料のモルヒネやテバインなどの前駆体である。DOPA自身も医薬品として利用されており、微生物での合成経路の確立が注目されていた。DOPA合成が可能な酵素としてメラニン色素生成に関与するチロシナーゼがある (図2)。本酵素は酸素を酸化剤としてTyrからDOPA、続いてドパキノンへの2段階の酸化反応を触媒する2)。後半の反応速度が速く、DOPAを生成物として得るにはドパキノンを還元しなければならない。この他に、BH4を補酵素に用いるTyrHがある1)。これは酸素分子中の1つの酸素原子をTyr、もう一つをBH4の酸化に用いるため、DOPAが生成物として得られる (図1)。そこで、本酵素の微生物生産への応用について検討した。
図2 チロシナーゼの反応
大腸菌や酵母はゲノム情報や遺伝子機能に関する知見が充実し、プラスミドベクターや遺伝子ライブラリーなどの遺伝子工学ツールが豊富、遺伝子導入や破壊が容易など、他の宿主微生物よりも非常に扱い易く、物質生産に汎用される。補酵素BH4は動物に特異的であり、大腸菌や酵母は産生しない点がTyrH活用の障壁であった。また、反応中に一分子のBH4が酸化されるため再生経路 (プテリン-4α-カルビノールアミン脱水酵素 (PCD) とジヒドロプテリジン還元酵素 (DHPR) ) も必要である (図1)3)。このような状況から、筆者らは大腸菌でTyrHを機能させるためにはBH4生合成と再生経路の両方の導入も必須と考えた。種々の検討の結果、大腸菌がもつBH4類縁体であるテトラヒドロモナプテリン (MH4) が代替物として機能し、マウス由来TyrHとヒト由来BH4再生経路の導入によってDOPAが合成できることを明らかにした4)。これは大腸菌を宿主とした物質生産にBH4依存性の芳香族アミノ酸水酸化酵素を応用した初めての報告であった。大腸菌自身はMH4依存性の酵素をもたず、MH4の生物学的役割は不明である。
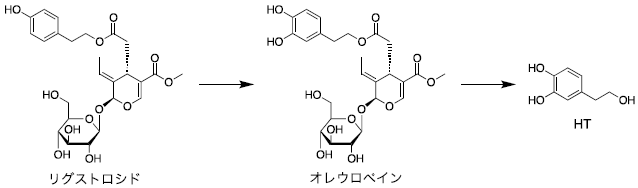
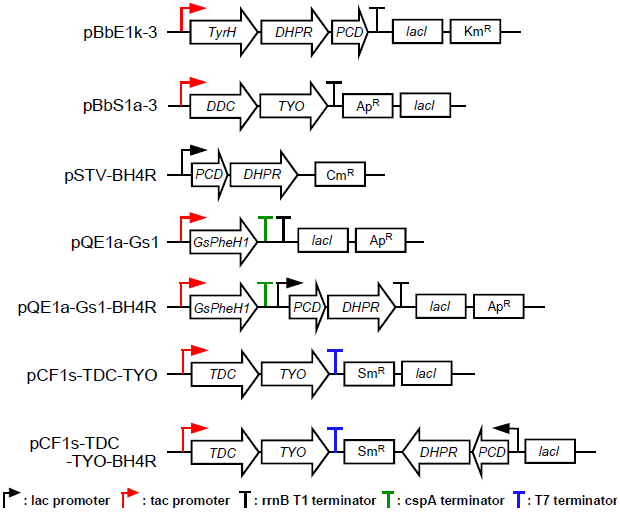
次に、天然から入手困難な抗酸化物質ヒドロキシチロソール (HT、図1) の生産への応用を検討した4)。HTはオリーブ等に含まれる強力な抗酸化物質で、その効果はビタミンCの10倍ともいわれる。抗酸化作用のほか、抗炎症・抗菌作用、メラニン産生や紫外線によるDNA損傷の抑制効果が知られ、サプリメント、化粧品やスキンケア用品の有効成分として使用されている5,6)。また抗ウイルス活性も知られており、パンデミックを引き起こした新型コロナウイルス感染症 (COVID-19) の感染予防効果も注目されている7)。その供給源はオリーブ果汁や葉エキスの濃縮物であるが、含有量の低さ、不純物の混在、個体・栽培エリアによるバラつき、季節性などから、高純度での配合や通年の安定供給に課題がある。また、HTはオレウロペインの部分構造として生合成されるため (図3)、加水分解し遊離する工程が必要である6)。オレウロペインはリグストロシドの水酸化によって生合成されると予想されており6)、このHT合成経路は複雑である。そこで、HTをダイレクトに合成するシンプルな経路をデザインした4)。図1に示すように、DOPAはDOPA脱炭酸酵素 (DDC) による脱炭酸、それに続くチラミン酸化酵素 (TYO) によるアミノ基の酸化、生成した3,4-ジヒドロキシフェニルアセトアルデヒド (DHPAAld) のアルコール脱水素酵素 (ADH) による還元反応を経てHTに変換される。検討の結果、大腸菌の内在性ADHでDHPAAldを還元できたため、DDCとTYO遺伝子をオペロンとして発現するプラスミドpBbS1a-3を構築し、DOPA合成関連遺伝子 (TyrH、PCDとDHPR遺伝子) を含むプラスミドpBbE1k-3と一緒に大腸菌に導入した (図4)。その結果、0.18 g/L (1.0 mM) Tyr添加培地で、0.029 g/L (0.19 mM) のHT生産に成功した4)。さらに、グルコースを炭素源に一次代謝経路で生合成されたTyrからHTを生産できることも確認した。
図3 オリーブにおける推定HT生合成経路

3.PheHの利活用
3-1 プラスミドを用いたTyr供給プラットフォームの開発
上述のように、目的化合物の合成経路のプロトタイプを実証できたら、生産性を最大化するため最適化が試みられる。基質や前駆体を添加した培地を用いて律速ステップを明らかにし改善するアプローチがあるが、Tyr誘導体に関しては、Tyrの水への溶解度が0.45 g/L (2.5 mM) と低いため、高濃度での添加は困難である8)。そこで、Tyr誘導体合成経路の迅速な最適化を可能とするプラットフォームの開発を検討した。
動物はPheHをもち、PheからTyrを生合成できる (図1)。Pheの水への溶解度は27 g/L (160 mM) とTyrよりも約60倍高い。そこで、PheHを用いたPheからTyrを高生産する簡便なプラットフォームの実現可能性を検討した9)。まず、PCDとDHPR遺伝子はオペロンを形成するように中コピーベクターpSTV28のlacプロモーター下流にクローニングした (pSTV-BH4R、図4)。構築したプラスミドで大腸菌を形質転換し、両酵素が可溶性タンパク質として発現することを確認した。次に、大腸菌での発現が確認されているラット由来PheH遺伝子をpSTV28と和合性を示す高コピーベクターpQE1aの強力なtac プロモーター制御下にクローニングし、その発現も確認した。正味のTyr生産を評価するため、Tyr合成能欠損大腸菌 (tyrA遺伝子破壊株、Y0株) を宿主とした。両プラスミドを導入したY0株を5.0 g/L (30 mM) Phe含有培地で培養したところ、Tyr生産量は0.20 g/L (1.1 mM)、変換率は3.6%と低かった (図5A)。改善のため、他の酵素の利用を検討した。一部の細菌もPheH遺伝子をもつ10)。そこで、6種の異なる菌株からPheH遺伝子 (アミノ酸配列の同一性20~70%) を取得し、上記と同様の手法で評価した。その結果、Gulbenkiania 属細菌由来PheH1 (GsPheH1) 遺伝子発現株で最も高い変換能が確認され、培養48時間で4.5 g/L (25 mM、変換率83%) に達した (図5A、B)。したがって、以降の検討にはGsPheH1遺伝子を用いた。
Tyr誘導体合成経路の構築にもプラスミドを用いるため、Tyr供給に関わるプラスミドは最少にすべきである。そこで、GsPheH1遺伝子と補酵素再生関連遺伝子 (PCDとDHPR遺伝子) の全てを含むプラスミドpQE1a-Gs1-BH4R (図4) を構築した。本プラスミドで形質転換したY0株のTyr生産量は4.6 g/L (26 mM)、変換率は87%に改善された (図5C)。さらに、上述のプラスミドを2つ導入した株と比較して、培養24時間でのTyr生産量が大きく向上していた (図5B、C)。これは抗生物質耐性の獲得やプラスミドDNAの合成による代謝負荷の軽減効果と考えられた。また、補酵素再生経路が効果的に機能していることも明らかとなり、芳香族アミノ酸水酸化酵素の有用物質生産への応用可能性が示された。以上のように、プラスミドを用いたTyr供給プラットフォームを構築した。
次に、プラットフォームの有用性をTyr誘導体生産で評価した。ここではチロソール (4-ヒドロキシフェニルエタノール、図1) をターゲットとした。チロソールはオリーブオイル、醸造酒などに含まれる天然化合物であり、健康増進や心疾患等の予防効果を示す抗酸化物質として知られている。他方、高血圧や心疾患の治療薬メトプロロールやベタキソロールなどの医薬品原料として使用されるだけでなく、熱硬化性樹脂の原料としても注目されている11)。現在は化学合成品が市販されている。筆者らは、植物および微生物由来酵素を組合せた人工的なチロソール合成経路を設計し、合成生物学的アプローチで大腸菌への実装に成功しており12)、それを適用した。上述のHT合成経路のように、TyrはTyr脱炭酸酵素 (TDC) による脱炭酸とそれに続くチラミン酸化酵素 (TYO) によるアミノ基の酸化、生成したヒドロキシフェニルアセトアルデヒド (HPAAld) のアルコール脱水素酵素 (ADH) による還元反応を経てチロソールへ変換される (図1)。HPAAldの還元反応にも宿主の内在性ADHが利用できたため、TDCおよびTYO遺伝子をオペロンとして発現し、pQE1aプラスミドと和合性を示すpCF1s-TDC-TYO (図4) を構築し、Tyr生産株に導入した9)。Phe添加培地で72時間培養した結果、チロソール生産量は以前の報告の約10倍 (1.6 g/L 、12 mM) に向上した。このように、本プラットフォームは1 g/L以上のTyr誘導体の生産を達成できることがわかった。
3-2 染色体工学によるTyr供給プラットフォームの開発
染色体工学は、目的DNAを染色体上の任意の位置に挿入した宿主の開発を可能にする。プラスミドを用いる方法と比較して、培地に抗生物質を添加することなく導入遺伝子の遺伝的安定性を高めることができるだけでなく、プラスミド維持に伴う代謝負荷を軽減できる利点がある。さらに、目的化合物の合成経路を有するプラスミドの許容範囲が広がり、より汎用的なプラットフォームとなる。そこで、プラスミドpQE1a-Gs1-BH4RからGsPheH1、PCDとDHPR遺伝子を含むDNA領域 (Tyr生産遺伝子カセット) をPCRで増幅し、Y0株染色体上のtyrA遺伝子破壊領域へ導入した (GsBR1株) 9)。培養48時間のTyr生産量は、0.046 g/L (0.25 mM) と非常に低かった (図6)。Tyr生産遺伝子カセットはGsBR1株では1コピーであるのに対し、プラスミドpQE1a-Gs1-BH4R導入株では約30コピーであり、遺伝子コピー数の減少がTyr生産量の低下に影響したと考えられた。そこで、大腸菌染色体の異なる領域にTyr生産遺伝子カセットが2~5コピーとなるように段階的に導入されたGsBR2~GsBR5株を構築した。それらのTyr生産量は、導入したカセット数に比例して0.59 g/L (3.2 mM) まで向上した (図6)。そこでGsBR5株をプラスミドフリーなプラットフォームとした。
本プラットフォームの有用性をDOPA生産で評価した9)。2節で使用したマウス由来TyrH遺伝子とBH4再生関連遺伝子をオペロンとして発現するプラスミドpBbE1k-3 (図4) を導入した結果、1.0 g/L (5.3 mM) のDOPA生産が確認された。このように、プラスミドフリーなプラットフォームでも、1 g/LのTyr誘導体生産が可能であることがわかった。また、Tyrの蓄積が認められたことから、DOPA合成反応が律速ステップであった。
興味深いことに、生成されたDOPAは宿主のTyr生産量を超えていた。この原因として、プラスミドで導入したBH4再生関連遺伝子の効果が予想された。この検証のため、GsBR5株に上述の補酵素再生関連遺伝子発現プラスミドpSTV-BH4RまたはGsPheH1遺伝子発現プラスミドpQE1a-Gs1 (図4) をそれぞれ導入した。それらのTyr生産量は、GsPheH1遺伝子導入株では0.98 g/L (5.4 mM) であったのに対し、BH4再生関連遺伝子導入株では2.9 g/L (16 mM) に大幅に向上した (図6)。以上より、GsBR5株では補酵素再生経路が律速反応と判明した。
次に、HT生産について検討した9)。2つのプラスミドpBbE1k-3とpBbS1a-3を導入したGsBR5株のHT生産量は0.023 g/L (0.15 mM) と予想に反し低かった。本株においては生育阻害が確認され、HT生産における改善点を明らかにした。
さらに、チロソール生産で評価した9)。上述のチロソール生産用プラスミドpCF1s-TDC-TYOを導入したGsBR5株は、0.61 g/L (4.4 mM) のチロソールを生産した。補酵素再生経路強化のため、pCF1s-TDC-TYOにBH4再生関連遺伝子オペロンを挿入したプラスミドpCF1s-TDC-TYO-BH4R (図4) を構築し評価したところ、約2倍 (1.3 g/L 、9.3 mM) になった。このように1 g/L以上のチロソールの高生産には補酵素再生経路の強化が必要であることが示された。
以上のように、染色体工学で構築したプラットフォームでも1 g/L以上のTyr誘導体を生産でき、生産性向上の改善点の解明にも有効であった。また、プラスミドフリーなため、よりフレキシブルな代謝経路設計も可能であった。
3.おわりに
筆者らはBH4依存性の芳香族アミノ酸水酸化酵素に必須な補酵素の課題を克服することで、微生物による有用化合物生産の可能性を拡大することに成功した。TyrHを用いるDOPA供給経路の確立は、大腸菌や酵母によるモルヒネ類やその前駆体の生産を可能にした13–15)。また、PheHを利用した簡便な高Tyr供給プラットフォームの活用によって、1 g/L以上のTyr誘導体の生産や律速ステップの解明ができることを実証した。Tyr誘導体は多様で工業用途でも重要な化合物である。現在はプラスミド導入株と同程度のTyr供給能をもつプラスミドフリーなプラットフォームの開発にも成功しており16)、誘導体生産経路の開発効率の飛躍的な向上による実用化までの期間短縮が期待される。
謝辞
本研究を遂行するにあたり、ご助言を賜りました北海道大学 大利徹教授、味の素株式会社 福井啓太主任研究員、ならびに大阪産業技術研究所 駒大輔主任研究員に感謝申し上げます。
文献
1) Fitzpatrick, P. F.: Arch. Biochem. Biophys., 735, 109518 (2023).
2) Xu, D.-Y., Chen, J.-Y., Yang, Z.: Biochem. Eng. J., 63, 88 (2012).
3) Thöny, B., Auerbach, G., Blau, N.: Biochem. J., 347, 1 (2000).
4) Satoh, Y., Tajima, K., Munekata, M., Keasling, J. D., Lee., T. S.: Metab. Eng., 14, 603 (2012).
5) Martínez-Zamora, L., Peñalver, R., Ros, G., Nieto, G.: Foods, 10, 2611 (2021).
6) Omar, S. H.: Sci. Pharm., 78, 133 (2010).
7) Paolacci, S., Ergoren, M. C., De Forni, D., Manara, E., Poddesu, B., Cugia, G., Dhuli, K., Camilleri, G., Tuncel, G., Kaya Suer, H., Sultanoglu, N., Sayan, M., Dundar, M., Beccari, T., Ceccarini, M. R., Gunsel, I. S., Dautaj, A., Sanlidag, T., Connelly, S. T., Tartaglia, G. M., Bertelli, M.: Eur. Rev. Med. Pharmacol. Sci., 25, 81 (2021).
8) Zimmer, A., Mueller, R., Wehsling, M., Schnellbaecher, A., von Hagen, J.: J. Biotechnol., 186, 110 (2014).
9) Satoh, Y., Fukui, K., Koma, D., Shen, N., Lee, T. S.: Biotechnol. Biofuels Bioprod., 16, 115 (2023).
10) Pribat, A., Blaby, I. K., Lara-Nunez, A., Gregory III, J. F., de Crecy-Lagard, V., Hanson, A. D.: J. Bacteriol., 192, 475 (2010).
11) Granado, L., Tavernier, R., Henry, S., Auke, R. O., Foyer, G., David, G., Caillol, S.: ACS Sustain. Chem. Eng., 7, 7209 (2019).
12) Satoh, Y., Tajima, K., Munekata, M., Keasling, J. D., Lee, T. S.: J. Agric. Food Chem., 60, 979 (2012).
13) Galanie, S., Thodey, K., Trenchard, I. J., Filsinger Interrante, M., Smolke, C. D.: Science, 349, 1095 (2015).
14) Matsumura, E., Nakagawa, A., Tomabechi, Y., Ikushiro, S., Sakaki, T., Katayama, T., Yamamoto, K., Kumagai, H., Sato, F., Minami, H.: Sci. Rep., 8, 7980 (2018).
15) Nakagawa, A., Nakamura, S., Matsumura, E., Yashima, Y., Takao, M., Aburatani, S., Yaoi, K., Katayama, T., Minami, H.: Appl. Microbiol. Biotechnol., 105, 5433 (2021).
16) Shen, N., Satoh, Y., Koma, D., Ohashi, H., Ogasawara, Y., Dairi, T.: J. Biosci. Bioeng., 137, 115 (2024).