【トピックス】
細胞内結晶化を利用した酵素内包タンパク質結晶の創成
安部 聡、上野隆史
京府大院・生命環境、東京科学大・生命理工
1.はじめに
生体酵素は、温和な環境下で目的の化学反応を効率よく触媒するため、生体内での反応のみならず、食品、医療、洗剤など多くの産業利用に用いられており、生体酵素の人工的な機能化制御が期待されている。したがって、これまでこれらの生体酵素の安定利用を目的に、メソポーラスシリカや多孔性金属錯体などの多孔性材料に固定化する手法も開発されている。筆者らは、固体の生体材料としてタンパク質結晶を用いた研究をこれまで進めてきた。タンパク質結晶は、主にX線結晶構造解析によるタンパク質の3次元立体構造を決定するために用いられてきた。一方で、タンパク質結晶は、タンパク質分子が規則正しく配列した固体の集合体であり、内部には溶媒チャネルとよばれる多孔性空間が存在する。その内部表面には、アミノ酸側鎖の官能基が規則正しく並んでおり、アミノ酸側鎖との化学修飾や配位結合により機能性分子の固定化を可能にする1,2)。例えば、化学反応を触媒するAu微粒子、RuやFe錯体を固定化することによる固体触媒3-5)やCoPt微粒子合成による磁気物性制御6)、亜鉛ポルフィリンとRuクラスター固定化による光誘起電子伝達反応など7)、金属化合物とのハイブリット化により、タンパク質結晶に新たな機能を付与した機能化材料の創成が報告されている。これらの研究例からタンパク質結晶が機能性分子を固定化し、その反応性を制御する鋳型結晶として有用なことが示されてきた。しかしながら、鋳型となるタンパク質結晶を作成するには、大腸菌などの宿主で発現したタンパク質を単離精製したのちに結晶化するという、煩雑な過程を要する。したがって、鋳型結晶にはリゾチームをはじめとした結晶化が容易なタンパク質の利用に限られていた。そこで、筆者らは、細胞内で自発的に結晶を形成するタンパク質に着目し、結晶への酵素などの機能性タンパク質の細胞内直接内包による固体触媒創成を開発した。本章では、最新の結果を含めた筆者らの研究を紹介する。
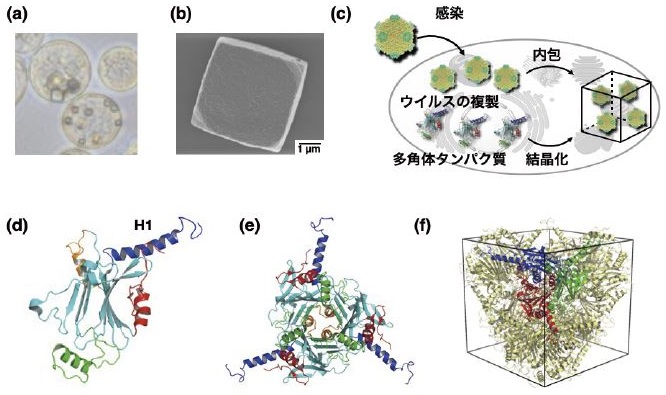
2.細胞内タンパク質結晶
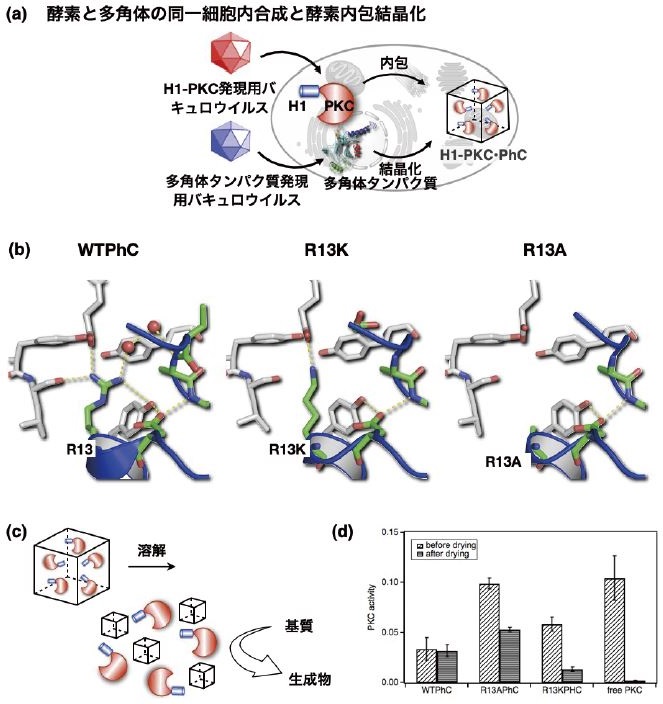
自然界には、細胞内で自発的に結晶を形成し、免疫活性化や固体触媒、ウイルスの貯蔵・保護など固体材料として機能するタンパク質が存在する。筆者らが細胞内タンパク質に着目した理由は、タンパク質結晶を迅速、簡便、大量に合成することが可能な点と、酵素をはじめとする細胞内分子との融合ができる点にある。細胞内タンパク質結晶は、タンパク質の精製や結晶化が不要であるため、従来の結晶化に必要なステップを大幅に短縮することができる8)。筆者らは、昆虫細胞で結晶を形成する「多角体」結晶を用いた機能創出を進めてきた。多角体 (Polyhedra Crystal, PhC) は、細胞質多角体病ウイルス (CPV) という昆虫ウイルスが感染した細胞内で産生されるタンパク質結晶である。多角体の興味深い特徴として、CPVを内包しながら結晶化し、長期にわたりCPVの保存を可能とする (図1)。2007年に報告された結晶構造から多角体は3量体構造が密にパッキングした構造をとるため、非常に高い安定性を示し、内包したCPVの安定保存を可能にしている9,10)。そこで、筆者らはこの性質を利用した酵素の固定化材料を構築してきた。多角体タンパク質は、結晶内でN末端のH1ヘリックスが周辺の多角体タンパク質と相互作用することで結晶を形成している。そこで、H1ヘリックスをタグペプチドとして、目的の酵素に融合することにより、多角体内部への固定化を試みた。まず、リン酸化酵素であるProtein Kinase C (PKC)の多角体結晶への固定化を目的としてH1ヘリックスをPKCのN末端に融合したH1-PKCを作成し、1つの細胞内で多角体タンパク質と共発現することにより、H1-PKCを内包した結晶を合成した (H1-PKC@ PhC)11)。多角体は、非常に安定な結晶であり、pH10以上のアルカリ溶液で溶解する。したがって、結晶を溶解して酵素を放出し機能化するには溶解するpHが高すぎるため、低いpHで溶解する結晶を設計した。H1ヘリックスに位置するArg13をLysやAlaに置換した変異体がpH8.5で溶解することを見出した (図2)。これらの変異体とH1-PKCを昆虫細胞内で共発現し作成した複合結晶は、H1-PKCを結晶内に固定化することができ、pH8.5で結晶を溶解させるとH1-PKCを放出しリン酸化反応を触媒する (図2c)。多角体は、乾燥に対しても安定で内包した酵素を保護するため、1週間の乾燥下に複合結晶を保存しておいてもpH8.5で溶解することにより活性を維持したH1-PKCを放出する (図2d)。この成果は、酵素を細胞内で結晶に固定化し活性を維持したまま保存できること、さらに酵素を利用したい時に結晶を溶解すれば利用できることを示しており、酵素の保存や運搬材料としての利用も期待される。


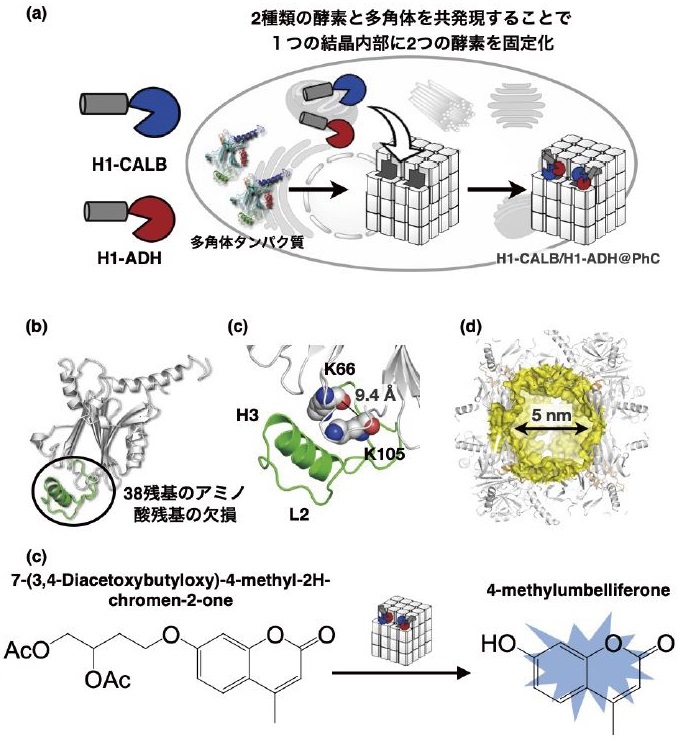
次に、多角体結晶の内部空間を設計することで、結晶を溶解せずに固体のまま酵素反応を活性化できないかと考えた。そこで、2種類の酵素を1つの結晶内に内包するカスケード反応触媒を合成した12)。Candida antarctica lipase (CALB) とLactobacillus kefir alcohol dehydrogenase (ADH)にH1ヘリックスを融合したH1-CALBとH1-ADHを多角体タンパク質と共発現することで結晶内に2つの酵素を内包した多角体を合成した (図3a)。この複合結晶は、H1-CALBとH1-ADHによる加水分解反応と酸化反応によるカスケード反応を触媒する。多角体結晶の設計として、結晶化に関与しない38残基を欠損したd38PhCを用いた。d38PhCは、モノマーが24個集積した結晶格子の中に5nmほどの空洞を形成し、酵素の固定化や基質分子の拡散が野生型と比べ向上すると期待される。実際に、野生型と比べ、1.9倍高いカスケード反応活性を示した (図3b-d)。また、H1-CALB、H1-ADHをそれぞれ内包した2種類の結晶を用いた場合と比較して、2種類の酵素を内包した1つの結晶は3倍活性が高い。2つの酵素が結晶内で近接しているために、カスケード反応がより進行すると考えられる。これらの結果は、多角体内部には複数の酵素活性部位を固定化した触媒系を構築できることを示している。

3.人工光合成固体触媒の開発
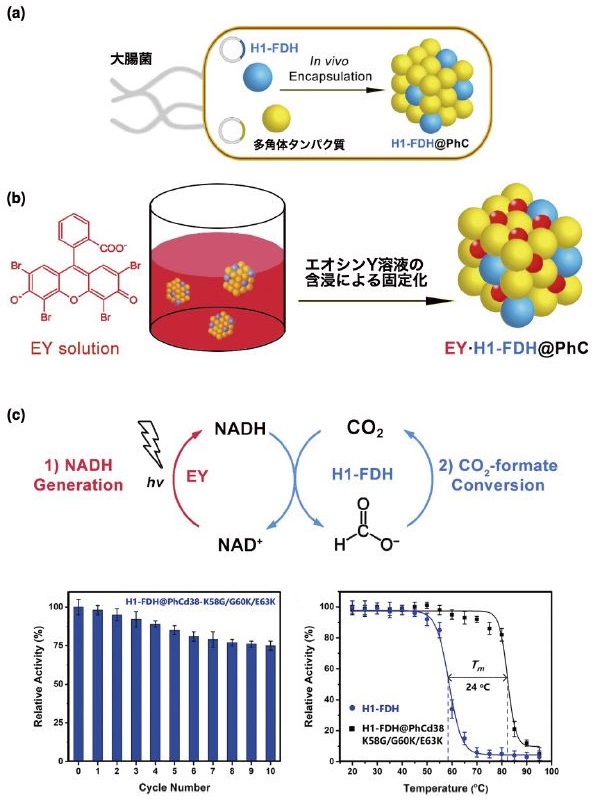
次に、これまでのタンパク質酵素内包技術を用いて、人工光合成触媒を合成した。1つのタンパク質結晶内部に酵素と光増感剤を同時に固定化した。まず、大腸菌内で多角体タンパク質とH1を融合したギ酸脱水素酵素 (H1-FDH) を共発現し、H1-FDHを多角体へ内包したH1-FDH@PhCを合成した (図4a)13)。大腸菌を用いた結晶化では、従来の昆虫細胞内での結晶化とくらべ、迅速、簡便かつ大量に結晶を合成することができるため、幅広い利用が期待できる。光増感剤としてEosin Y (EY) を用いた。結晶内での反応性向上を目的とし、カスケード反応でも用いたd38PhC変異体結晶を用いた。さらに、負電荷のEYの結合を安定化させるため、アミノ酸置換により正電荷アミノ酸を結晶内に導入した。分子動力学 (MD) シミュレーションにより、d38-K58G/G60K/E63K PhCを設計した。WTPhCを用いた場合は、H1-FDHがほとんど内包されなかったが、d38-K58G/G60K/E63K PhCでは、H1-FDHの固定化がSDS-PAGEにより確認でき、欠損変異体を用いることで、多くのH1-FDHを固定化することに成功した。合成したH1-FDH@ d38-K58G/G60K/E63K PhCをEY溶液に浸すことにより、EYを複合結晶内に固定化した (図4b)。UV-vis測定結果から、結晶内の多角体タンパク質24量体 (ユニットセル) あたり、1.15個のEYが固定化されることが示された。これは、WTPhCと比較して2.7倍固定化量が向上したことを示している。触媒反応は、複合結晶に光照射し、NADHと飽和CO2存在下で、CO2の還元反応を行なったところ、ギ酸の生成が確認された (図4c)。生成物であるギ酸の炭素源を13CO2を用いた安定同位体分析によって反応追跡を行った結果、ギ酸がガス状のCO2から生じたことが示された。また、この複合結晶は、反応後、遠心分離で結晶を回収し、再度反応を行う再利用において、10回の再利用でも75%の活性を維持することや酵素の熱安定性 (Tm) が溶液状態のH1-FDHと比べて24℃も上昇することが示された (図4d)。天然酵素であるFDHと人工分子であるEYをタンパク質結晶に固定化することにより、光捕集型のCO2還元反応を促進する結晶材料を構築した。これらの結果は、細胞内結晶化を用いた環境低負荷型で高効率な触媒合成へと発展すると期待される。

4.細胞内結晶化を利用したケージタンパク質の固定化
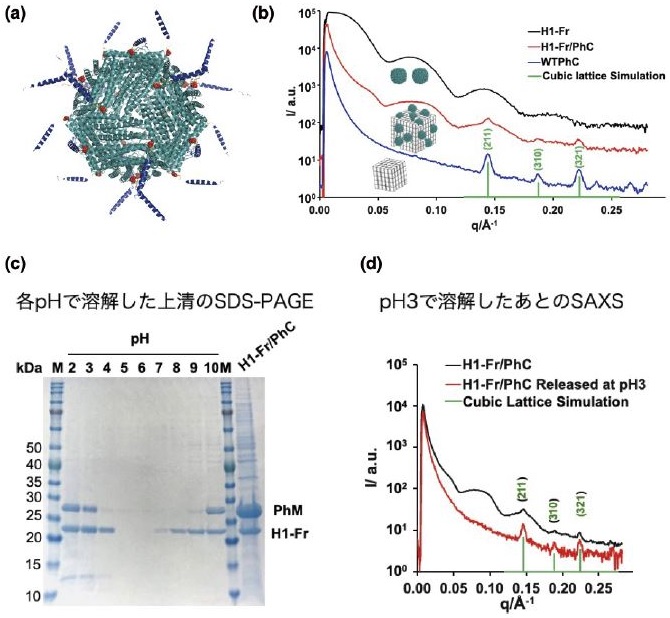
次に、融合結晶のさらなる発展として、タンパク質集合体であるフェリチン (Ferritin, Fr) の結晶内固定化を行った。フェリチンは単量体が24個集積したケージタンパク質であり、これまで金属錯体との複合化による人工金属酵素のテンプレートとしても用いられており、多角体と融合することにより多角体のさらなる機能化が期待できる。そこで、フェリチンの24量化と多角体の細胞内合成を同時に行い、フェリチンケージの多角体への固定化を行った14)。多角体とフェリチンの複合化には、これまでの酵素の固定化と同様にH1ヘリックスをN末端に融合したフェリチン変異体 (H1-Fr) を作成した。フェリチンが24量化することで、24個のH1ヘリックスがフェリチン外部表面に露出し、多角体に固定化される (図5a)。実際に、H1を融合していないWTのフェリチンと多角体タンパク質との共発現では、フェリチンは固定化されなかったものの、H1-Frとの共発現では、H1-Frが固定化されたことがSDS-PAGEで示された。タンパク質モノマーであるH1-sfGFPを共発現した場合と比較すると、多角体モノマーあたり、270倍、H1-Frのほうが固定化量が多いことがわかった。これは、フェリチン表面の24個のH1ヘリックスが多角体タンパク質との多点的な相互作用により効率的な多角体への固定化を促進していることを示している。小角X線散乱 (SAXS) 測定により、合成した複合結晶内のフェリチン構造や結晶構造を確認したところ、ケージ構造を示す散乱ピークと結晶性を示すブラッグピークが観測された (図5b)。これは、多角体とFr ケージが共存していることを示している。また、pH3で複合結晶を溶解させ、溶解した溶液のSAXSや電子顕微鏡観察では、結晶から放出されたH1-Frが、ケージ構造を維持していることも示された。さらに、種々の測定からH1-Frは、多角体の表面に集積していることやpH刺激によって表面から放出されることも示された (図5c, 5d)。本手法を用いH1-Frと多角体タンパク質を細胞内で共発現するだけで、H1-Frの24量化と多角体の結晶化、H1-Frの固定化が細胞内で行われる。したがって、タンパク質モノマーだけでなく、タンパク質集合体や複数種類のタンパク質によって形成される複合タンパク質なども結晶内に固定化できる可能性が示された。

5.おわりに
本章では、細胞内タンパク質結晶化反応を利用し酵素の固定化による固体触媒の開発について紹介した。この手法は、タンパク質の結晶化と同時に細胞内で合成される酵素やタンパク質集合体を結晶内に内包することができるため、複雑なタンパク質の精製工程を経ずに固体触媒など結晶材料の簡便な合成を可能とする。また、鋳型となるタンパク質結晶のアミノ酸置換や欠損など、多数の変異体結晶の迅速な合成スクリーニングを可能とし、高効率なタンパク質結晶材料を構築できる。この手法は、不安定性や低収量のために利用が困難とされてきた酵素のみならず、抗体やウイルス粒子など様々なタンパク質の固定化にも応用でき、多様な機能をもつ固体材料合成につながり、生体材料科学や構造生物学に著しい進歩をもたらすと考えられる。
文献
1) Abe, K., Ueno, T.: RSC Adv., 2015, 21366 (2015).
2) Abe, S., Maity, B., Ueno, T.: Chem. Commun., 52, 6496 (2016).
3) Lopez, S., Rondot, L., Lepretre, C., Marchi-Delapierre, C., Menage, S., Cavazza, C.: J. Am. Chem. Soc., 139, 17994 (2017).
4) Tabe, H., Abe, S., Hikage, T., Kitagawa, S., Ueno, T.: Chem. Asian J., 9, 1373 (2014).
5) Eei, H., Lu, Y.: Chem. Asian J., 7, 680 (2012).
6) Abe, S., Tsujimoto, M., Yoneda, K., Ohba, M., Hikage, T., Takano, M., Kitagawa, S., Ueno, T.: Small, 8, 1314 (2012).
7) Koshiyama, T., Shirai, M., Hikage, T., Tabe, H., Tanaka, K., Kitagawa, S., Ueno, T.: Angew. Chem. Int. Ed., 50, 4849 (2011).
8) Mudogo, C. N., Falke, S., Brognaro, H., Duszenko, M., Betzel, C.: Traffic, 21, 220 (2020).
9) Coulibaly, F., Chiu, E., Ikeda, K., Gutmann, S., Haebel, P., Schulze-Briese, C., Mori, H., Metcalf, P.: Nature, 446, 97 (2007).
10) Schonkerr, R., Rudolph, J. M., Redecke, L.: Biol. Chem., 399, 751 (2018).
11) Abe, S., Ijiri, H., Negishi, H., Yamanaka, H., Sasaki, K., Hirata, K., Mori, H., Ueno, T.: Adv. Mater., 27, 7951 (2015).
12) Nguyen, T. K., Abe, S., Kasamatsu, M., Maity, B., Yamashita, K., Hirata, K., Kojima, M., Ueno, T.: ACS Appl. Nano Mater., 4, 1672 (2021).
13) Pan, T. Z., Maity, B., Abe, S., Morita, T., Ueno, T.: Nano Lett., 23, 6744 (2023).
14) Pham, T. T., Abe, S., Date, K., Hirata, K., Suzuki, T., Ueno, T.: Nano Lett., 23, 10118 (2023).